题目
砷元素广泛存在于自然界,砷与其化合物被运用在农药、除草剂、杀虫剂等。(1)砷的常见氧化物有AS2O3和As2O5,As2O5热稳定性差。根据图1写出As2O5分解为AS2O3的热化学方程式 ____ 。能量-|||-2As(s)+(-O)(g)-|||-△H2=-119.2kJ-mol^4-|||-△H2=-914.6km·m ol-|||-AS2O2(s)+O2(g)-|||-AS2O2(5)-|||-图 1 反应过程-|||-c c(I2)/mol·L^(-1)-|||-0.015-|||-0 10 t/min-|||-图2(2)砷酸钠具有氧化性,298K时,在100 mL,烧杯中加入10 mL0.1mol•L-1Na3AsO4溶液、20 mL 0.1mol•L-1KI溶液和20 mL 0.05mol/L硫酸溶液,发生反应:AsO43-(无色)+2I-+2H+⇌AsO33-(无色)+I2(浅黄色)+H2O△H0测得溶液中c(I2)与时间(t)的关系如图2所示(忽略溶液体积变化)。①下列情况表明上述反应达到平衡状态的是 ____ (填序号)。a.溶液颜色不再变化b.c(AsO33-)+c(AsO43-)不再变化c.AsO43-的生成速率等于I2的生成速率d.(c(As(O)_(3)^3-))/(c((I)_{2))}保持不再变化②0~10rain内,I-的反应速率v(I-)= ____ 。③在该条件下,上述反应的平衡常数K= ____ 。④升温,AsO43-的平衡转化率减小,则该反应的△H ____ 0(填“大于”“小于”或“等于”)。(3)利用(2)中反应可测定含As2O3和As2O5的试样中的各组分含量(所含杂质对测定无影响),过程如下:①将试样0.2000g溶于NaOH溶液,得到含AsO33-和AsO43-的混合溶液。②上述混合液用0.02500mol•L-1的I2溶液滴定,用 ____ 做指示剂进行滴定。重复滴定2次,平均消耗I2溶液40.00 mL.则试样中As2O5的质量分数是 ____ 。
砷元素广泛存在于自然界,砷与其化合物被运用在农药、除草剂、杀虫剂等。
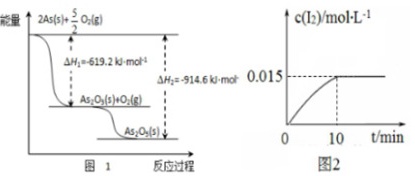
(1)砷的常见氧化物有AS2O3和As2O5,As2O5热稳定性差。根据图1写出As2O5分解为AS2O3的热化学方程式 ____ 。
(2)砷酸钠具有氧化性,298K时,在100 mL,烧杯中加入10 mL0.1mol•L-1Na3AsO4溶液、20 mL 0.1mol•L-1KI溶液和20 mL 0.05mol/L硫酸溶液,发生反应:
AsO43-(无色)+2I-+2H+⇌AsO33-(无色)+I2(浅黄色)+H2O△H0测得溶液中c(I2)与时间(t)的关系如图2所示(忽略溶液体积变化)。
①下列情况表明上述反应达到平衡状态的是 ____ (填序号)。
a.溶液颜色不再变化
b.c(AsO33-)+c(AsO43-)不再变化
c.AsO43-的生成速率等于I2的生成速率
d.$\frac{c(As{O}_{3}^{3-})}{c({I}_{2})}$保持不再变化
②0~10rain内,I-的反应速率v(I-)= ____ 。
③在该条件下,上述反应的平衡常数K= ____ 。
④升温,AsO43-的平衡转化率减小,则该反应的△H ____ 0(填“大于”“小于”或“等于”)。
(3)利用(2)中反应可测定含As2O3和As2O5的试样中的各组分含量(所含杂质对测定无影响),过程如下:
①将试样0.2000g溶于NaOH溶液,得到含AsO33-和AsO43-的混合溶液。
②上述混合液用0.02500mol•L-1的I2溶液滴定,用 ____ 做指示剂进行滴定。重复滴定2次,平均消耗I2溶液40.00 mL.则试样中As2O5的质量分数是 ____ 。
(1)砷的常见氧化物有AS2O3和As2O5,As2O5热稳定性差。根据图1写出As2O5分解为AS2O3的热化学方程式 ____ 。

(2)砷酸钠具有氧化性,298K时,在100 mL,烧杯中加入10 mL0.1mol•L-1Na3AsO4溶液、20 mL 0.1mol•L-1KI溶液和20 mL 0.05mol/L硫酸溶液,发生反应:
AsO43-(无色)+2I-+2H+⇌AsO33-(无色)+I2(浅黄色)+H2O△H0测得溶液中c(I2)与时间(t)的关系如图2所示(忽略溶液体积变化)。
①下列情况表明上述反应达到平衡状态的是 ____ (填序号)。
a.溶液颜色不再变化
b.c(AsO33-)+c(AsO43-)不再变化
c.AsO43-的生成速率等于I2的生成速率
d.$\frac{c(As{O}_{3}^{3-})}{c({I}_{2})}$保持不再变化
②0~10rain内,I-的反应速率v(I-)= ____ 。
③在该条件下,上述反应的平衡常数K= ____ 。
④升温,AsO43-的平衡转化率减小,则该反应的△H ____ 0(填“大于”“小于”或“等于”)。
(3)利用(2)中反应可测定含As2O3和As2O5的试样中的各组分含量(所含杂质对测定无影响),过程如下:
①将试样0.2000g溶于NaOH溶液,得到含AsO33-和AsO43-的混合溶液。
②上述混合液用0.02500mol•L-1的I2溶液滴定,用 ____ 做指示剂进行滴定。重复滴定2次,平均消耗I2溶液40.00 mL.则试样中As2O5的质量分数是 ____ 。
题目解答
答案
解:(1)由图象可知,As2O5分解为As2O3需要吸收的热量为-619kJ/mol-(-914.6kJ/mol)=+295.4 kJ•mol-1,则热化学方程式As2O5(s)=As2O3(s)+O2(g)△H=+295.4 kJ•mol-1,
故答案为:As2O5(s)=As2O3(s)+O2(g)△H=+295.4kJ•mol-1;
(2)①AsO43-+2I-+2H+⇌AsO33-+I2+H2O,
(无色) (无色)(浅黄色)
a.溶液颜色不再变化说明离子浓度不变,反应达到平衡状态,故a正确;
b.反应前后守恒可知c(AsO33-)+c(AsO43-)始终不变,不能说明反应达到平衡状态,故b错误;
c.AsO43-的生成速率等于I2的生成速率,说明反应达到平衡状态,故c正确;
d.AsO33-和I2,生成物质的量相同,c(AsO33-)/c(I2)始终保持不再变化,不能说明反应达到平衡状态,故d错误;
故答案为:ac;
②图2可知,I2浓度变化为0.015mol/L,I-浓度变化0.03mol/L,0-10minv(I-)=$\frac{0.03mol/L}{10min}$=0.003mol/(L•min),
故答案为:0.003mol/(L•min);
③AsO43-+2I-+2H+⇌AsO33-+I2+H2O
起始量(mol/L) 0.02 0.04 0.04 0 0
变化量(mol/L) 0.015 0.03 0.03 0.015 0.015
平衡量(mol/L)0.005 0.01 0.01 0.015 0.015
K═$\frac{0.015×0.015}{0.005×0.0{1}^{2}×0.0{1}^{2}}$=4.5×106,
故答案为:4.5×106;
④升温,AsO43-的平衡转化率减小,说明平衡逆向进行,正反应为放热反应,△H小于0,
故答案为:小于;
(3)②将试样As2O3和As2O50.2000g溶于NaOH溶液,得到含AsO33-和AsO43-的混合溶液,上述混合液用0.02500mol.L-1的I2溶液滴定,选择淀粉溶液为指示剂,滴入最后一滴溶液变蓝色,重复滴定2次,平均消耗I2溶液40.00mL。
AsO33-+I2+H2O=AsO43-+2I-+2H+,
1 1
n 0.02500mol/L×0.04000L
n=0.001mol,
则试样中As2O5的质量分数=$\frac{0.2000g-0.001mol×\frac{1}{2}×198g/mol}{0.2000g}$×100%=50.5%,
故答案为:淀粉溶液;50.5%。
故答案为:As2O5(s)=As2O3(s)+O2(g)△H=+295.4kJ•mol-1;
(2)①AsO43-+2I-+2H+⇌AsO33-+I2+H2O,
(无色) (无色)(浅黄色)
a.溶液颜色不再变化说明离子浓度不变,反应达到平衡状态,故a正确;
b.反应前后守恒可知c(AsO33-)+c(AsO43-)始终不变,不能说明反应达到平衡状态,故b错误;
c.AsO43-的生成速率等于I2的生成速率,说明反应达到平衡状态,故c正确;
d.AsO33-和I2,生成物质的量相同,c(AsO33-)/c(I2)始终保持不再变化,不能说明反应达到平衡状态,故d错误;
故答案为:ac;
②图2可知,I2浓度变化为0.015mol/L,I-浓度变化0.03mol/L,0-10minv(I-)=$\frac{0.03mol/L}{10min}$=0.003mol/(L•min),
故答案为:0.003mol/(L•min);
③AsO43-+2I-+2H+⇌AsO33-+I2+H2O
起始量(mol/L) 0.02 0.04 0.04 0 0
变化量(mol/L) 0.015 0.03 0.03 0.015 0.015
平衡量(mol/L)0.005 0.01 0.01 0.015 0.015
K═$\frac{0.015×0.015}{0.005×0.0{1}^{2}×0.0{1}^{2}}$=4.5×106,
故答案为:4.5×106;
④升温,AsO43-的平衡转化率减小,说明平衡逆向进行,正反应为放热反应,△H小于0,
故答案为:小于;
(3)②将试样As2O3和As2O50.2000g溶于NaOH溶液,得到含AsO33-和AsO43-的混合溶液,上述混合液用0.02500mol.L-1的I2溶液滴定,选择淀粉溶液为指示剂,滴入最后一滴溶液变蓝色,重复滴定2次,平均消耗I2溶液40.00mL。
AsO33-+I2+H2O=AsO43-+2I-+2H+,
1 1
n 0.02500mol/L×0.04000L
n=0.001mol,
则试样中As2O5的质量分数=$\frac{0.2000g-0.001mol×\frac{1}{2}×198g/mol}{0.2000g}$×100%=50.5%,
故答案为:淀粉溶液;50.5%。