题目
.15-34 反应: +(O)_(2)arrow 2N(O)_(2) 若按下面的机理进行:-|||-.+NOxrightarrow ({K)_(1)}(N)_(2)(O)_(2) ._(1)=79.5kJcdot (mol)^-1-|||-._(2)(O)_(2)xrightarrow ({K)_(2)}2NO ._(2)=205kJcdot (mol)^-1-|||-._(2)(O)_(2)+(O)_(2)xrightarrow ({K)_(3)}2N(O)_(2) ._(3)=84kJcdot (mol)^-1-|||-(1)对[N2O2]做稳态近似处理,导出以 [ N(O)_(2)] /dt 表示的速率方程;(2)第一步生成的N2O2-|||-只有极少量用于第三步去生成产物,而绝大部分通过第二步转化为NO,据此事实,计算反-|||-应的表观活化能.

题目解答
答案
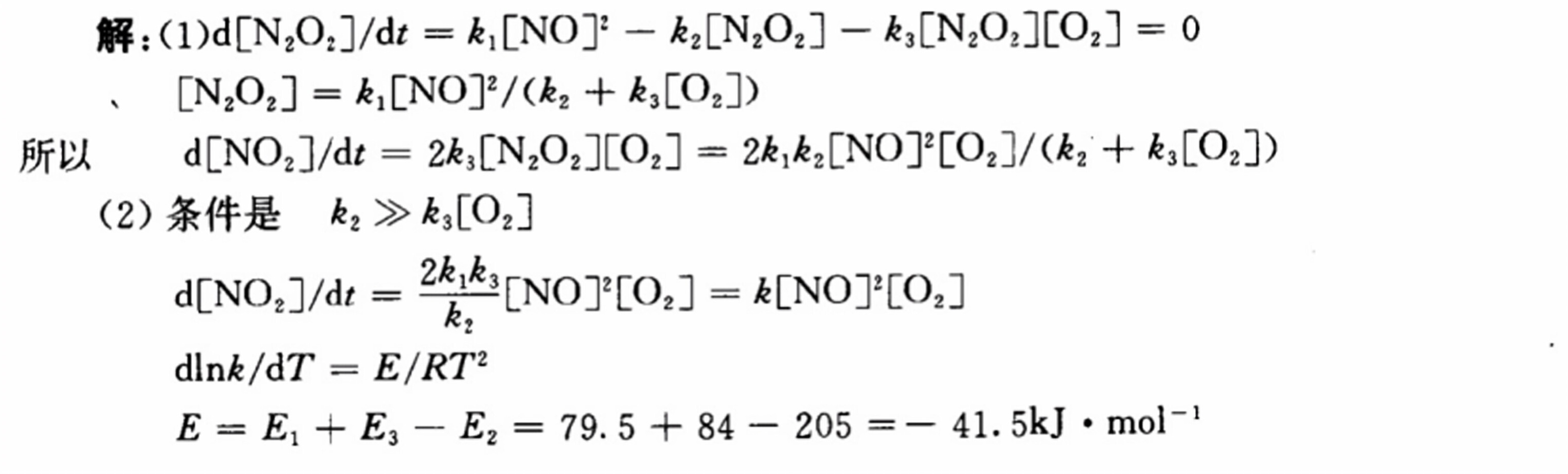
解析
步骤 1:稳态近似处理
对中间产物 ${N}_{2}{O}_{2}$ 进行稳态近似处理,即假设其浓度在反应过程中保持不变,即 $\frac{d[{N}_{2}{O}_{2}]}{dt} = 0$。根据反应机理,可以写出 ${N}_{2}{O}_{2}$ 的生成和消耗速率方程:
$$\frac{d[{N}_{2}{O}_{2}]}{dt} = k_{1}[NO]^2 - k_{2}[{N}_{2}{O}_{2}] - k_{3}[{N}_{2}{O}_{2}][{O}_{2}]$$
步骤 2:求解 ${N}_{2}{O}_{2}$ 的浓度
将 $\frac{d[{N}_{2}{O}_{2}]}{dt} = 0$ 代入上式,解得:
$$[{N}_{2}{O}_{2}] = \frac{k_{1}[NO]^2}{k_{2} + k_{3}[{O}_{2}]}$$
步骤 3:导出 $d[NO_{2}]/dt$ 的速率方程
根据反应机理,$NO_{2}$ 的生成速率等于 ${N}_{2}{O}_{2}$ 与 ${O}_{2}$ 反应的速率,即:
$$\frac{d[NO_{2}]}{dt} = 2k_{3}[{N}_{2}{O}_{2}][{O}_{2}]$$
将 ${N}_{2}{O}_{2}$ 的浓度代入上式,得:
$$\frac{d[NO_{2}]}{dt} = 2k_{3}\frac{k_{1}[NO]^2}{k_{2} + k_{3}[{O}_{2}]}[{O}_{2}]$$
步骤 4:计算表观活化能
根据题意,${k}_{2} \gg {k}_{3}[{O}_{2}]$,即 ${N}_{2}{O}_{2}$ 主要通过第二步转化为 $NO$,因此可以忽略 ${k}_{3}[{O}_{2}]$,简化速率方程为:
$$\frac{d[NO_{2}]}{dt} = \frac{2k_{1}k_{3}}{k_{2}}[NO]^2[{O}_{2}]$$
表观活化能 $E$ 可以通过反应的活化能之和减去逆反应的活化能来计算,即:
$$E = E_{1} + E_{3} - E_{2}$$
对中间产物 ${N}_{2}{O}_{2}$ 进行稳态近似处理,即假设其浓度在反应过程中保持不变,即 $\frac{d[{N}_{2}{O}_{2}]}{dt} = 0$。根据反应机理,可以写出 ${N}_{2}{O}_{2}$ 的生成和消耗速率方程:
$$\frac{d[{N}_{2}{O}_{2}]}{dt} = k_{1}[NO]^2 - k_{2}[{N}_{2}{O}_{2}] - k_{3}[{N}_{2}{O}_{2}][{O}_{2}]$$
步骤 2:求解 ${N}_{2}{O}_{2}$ 的浓度
将 $\frac{d[{N}_{2}{O}_{2}]}{dt} = 0$ 代入上式,解得:
$$[{N}_{2}{O}_{2}] = \frac{k_{1}[NO]^2}{k_{2} + k_{3}[{O}_{2}]}$$
步骤 3:导出 $d[NO_{2}]/dt$ 的速率方程
根据反应机理,$NO_{2}$ 的生成速率等于 ${N}_{2}{O}_{2}$ 与 ${O}_{2}$ 反应的速率,即:
$$\frac{d[NO_{2}]}{dt} = 2k_{3}[{N}_{2}{O}_{2}][{O}_{2}]$$
将 ${N}_{2}{O}_{2}$ 的浓度代入上式,得:
$$\frac{d[NO_{2}]}{dt} = 2k_{3}\frac{k_{1}[NO]^2}{k_{2} + k_{3}[{O}_{2}]}[{O}_{2}]$$
步骤 4:计算表观活化能
根据题意,${k}_{2} \gg {k}_{3}[{O}_{2}]$,即 ${N}_{2}{O}_{2}$ 主要通过第二步转化为 $NO$,因此可以忽略 ${k}_{3}[{O}_{2}]$,简化速率方程为:
$$\frac{d[NO_{2}]}{dt} = \frac{2k_{1}k_{3}}{k_{2}}[NO]^2[{O}_{2}]$$
表观活化能 $E$ 可以通过反应的活化能之和减去逆反应的活化能来计算,即:
$$E = E_{1} + E_{3} - E_{2}$$