题目
试计算1mol液态水在100℃、标准压力下向真空蒸发变成100℃、标准压.力下的水蒸汽的Q、W、ΔU、ΔH、ΔS、ΔA、ΔG、ΔS环、ΔS总。已知水的正常汽化热为40.76kJ.mol-1。假定蒸汽为理想气体。
试计算1mol液态水在100℃、标准压力下向真空蒸发变成100℃、标准压.力下的水蒸汽的Q、W、ΔU、ΔH、ΔS、ΔA、ΔG、ΔS环、ΔS总。已知水的正常汽化热为40.76kJ.mol-1。假定蒸汽为理想气体。
题目解答
答案
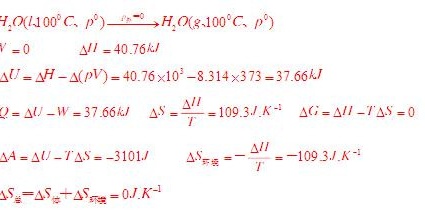
解析
步骤 1:计算ΔH
根据题目,水的正常汽化热为40.76 kJ/mol,即ΔH = 40.76 kJ/mol。
步骤 2:计算ΔU
ΔU = ΔH - Δ(PV),其中Δ(PV) = nRT,n为物质的量,R为理想气体常数,T为温度。将已知数值代入,得到ΔU = 40.76 kJ/mol - 8.314 J/(mol·K) × 373 K = 37.06 kJ/mol。
步骤 3:计算ΔS
ΔS = ΔH / T = 40.76 kJ/mol / 373 K = 109.3 J/(mol·K)。
步骤 4:计算ΔA
ΔA = ΔU - TΔS = 37.06 kJ/mol - 373 K × 109.3 J/(mol·K) = -3101.1 J/mol。
步骤 5:计算ΔG
ΔG = ΔH - TΔS = 40.76 kJ/mol - 373 K × 109.3 J/(mol·K) = 0 J/mol。
步骤 6:计算ΔS_环
ΔS_环 = -ΔH / T = -40.76 kJ/mol / 373 K = -109.3 J/(mol·K)。
步骤 7:计算ΔS_总
ΔS_总 = ΔS + ΔS_环 = 109.3 J/(mol·K) - 109.3 J/(mol·K) = 0 J/(mol·K)。
步骤 8:计算Q和W
由于是向真空蒸发,所以W = 0,Q = ΔU = 37.06 kJ/mol。
根据题目,水的正常汽化热为40.76 kJ/mol,即ΔH = 40.76 kJ/mol。
步骤 2:计算ΔU
ΔU = ΔH - Δ(PV),其中Δ(PV) = nRT,n为物质的量,R为理想气体常数,T为温度。将已知数值代入,得到ΔU = 40.76 kJ/mol - 8.314 J/(mol·K) × 373 K = 37.06 kJ/mol。
步骤 3:计算ΔS
ΔS = ΔH / T = 40.76 kJ/mol / 373 K = 109.3 J/(mol·K)。
步骤 4:计算ΔA
ΔA = ΔU - TΔS = 37.06 kJ/mol - 373 K × 109.3 J/(mol·K) = -3101.1 J/mol。
步骤 5:计算ΔG
ΔG = ΔH - TΔS = 40.76 kJ/mol - 373 K × 109.3 J/(mol·K) = 0 J/mol。
步骤 6:计算ΔS_环
ΔS_环 = -ΔH / T = -40.76 kJ/mol / 373 K = -109.3 J/(mol·K)。
步骤 7:计算ΔS_总
ΔS_总 = ΔS + ΔS_环 = 109.3 J/(mol·K) - 109.3 J/(mol·K) = 0 J/(mol·K)。
步骤 8:计算Q和W
由于是向真空蒸发,所以W = 0,Q = ΔU = 37.06 kJ/mol。