题目
NaCl是一种化工原料,可以制备多种物质,如图所示。NaOH-|||-H2O-|||-Cl2-|||-通电 点燃-|||-HCl-|||-NaCl H2-|||-Ca(OH)2 Ca(ClO)2-|||-熔融 Cl2-|||-通电 Na请根据以上转化关系填写下列空白。(1)氯化钠溶液通电后,发生反应的离子方程式为 ____ ,氢气在氯气中燃烧的现象是 ____ 。(2)Cl2与Ca(OH)2反应的化学方程式为 ____ 。从氧化剂和还原剂的角度分析,该反应中Cl2的作用是 ____ 。
NaCl是一种化工原料,可以制备多种物质,如图所示。
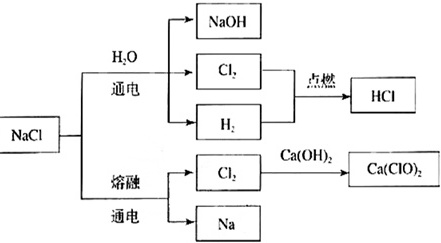
请根据以上转化关系填写下列空白。
(1)氯化钠溶液通电后,发生反应的离子方程式为 ____ ,氢气在氯气中燃烧的现象是 ____ 。
(2)Cl2与Ca(OH)2反应的化学方程式为 ____ 。从氧化剂和还原剂的角度分析,该反应中Cl2的作用是 ____ 。

请根据以上转化关系填写下列空白。
(1)氯化钠溶液通电后,发生反应的离子方程式为 ____ ,氢气在氯气中燃烧的现象是 ____ 。
(2)Cl2与Ca(OH)2反应的化学方程式为 ____ 。从氧化剂和还原剂的角度分析,该反应中Cl2的作用是 ____ 。
题目解答
答案
解:(1)氯化钠溶液通电后,阴极水电离的氢离子放电生成氢气,阳极氯离子放电生成氯气,发生反应的离子方程式为:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑+2OH-,氢气在氯气中燃烧生成氯化氢,现象是安静的燃烧,发出苍白色的火焰,瓶口有白雾,
故答案为:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑+2OH-;安静的燃烧,发出苍白色的火焰,瓶口有白雾;
(2)Cl2与Ca(OH)2反应的化学方程式为:Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,反应中氯气中氯元素的化合价既升高,又降低,氯气既是氧化剂,又是还原剂,
故答案为:Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;既是氧化剂,又是还原剂。
故答案为:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑+2OH-;安静的燃烧,发出苍白色的火焰,瓶口有白雾;
(2)Cl2与Ca(OH)2反应的化学方程式为:Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,反应中氯气中氯元素的化合价既升高,又降低,氯气既是氧化剂,又是还原剂,
故答案为:Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;既是氧化剂,又是还原剂。
解析
考查要点:
- 电解氯化钠溶液的离子反应:需明确电解时离子的放电顺序及产物判断。
- 氢气在氯气中燃烧的现象:需联系氢气燃烧生成HCl的特性。
- Cl₂与强碱反应的化学方程式:需掌握歧化反应中Cl₂的双重角色。
解题核心思路:
- 电解反应:阴极H⁺放电生成H₂,阳极Cl⁻放电生成Cl₂,水参与反应生成OH⁻。
- 燃烧现象:H₂在Cl₂中燃烧生成HCl气体,白雾是HCl溶于空气中的水蒸气形成。
- 歧化反应:Cl₂中Cl的化合价既升高(+1)又降低(-1),故Cl₂同时作氧化剂和还原剂。
第(1)题
第一空
关键步骤:
- 确定电解产物:
- 阴极:溶液中H⁺放电,生成H₂(2H⁺ + 2e⁻ → H₂↑)。
- 阳极:Cl⁻放电,生成Cl₂(2Cl⁻ → Cl₂↑ + 2e⁻)。
- 水参与反应生成OH⁻(2H₂O → 2H₂O)。
- 整合离子方程式:
$2\text{Cl}^- + 2\text{H}_2\text{O} \xrightarrow{\text{电解}} \text{H}_2↑ + \text{Cl}_2↑ + 2\text{OH}^-$
第二空
现象分析:
- 氢气在纯氧或氯气中燃烧时,火焰呈苍白色,生成HCl气体。
- HCl与空气中的水蒸气结合形成盐酸小液滴,故瓶口出现白雾。
第(2)题
第一空
化学方程式:
Cl₂与Ca(OH)₂发生歧化反应,生成CaCl₂、Ca(ClO)₂和水:
$\text{Cl}_2 + 2\text{Ca(OH)}_2 \rightarrow \text{CaCl}_2 + \text{Ca(ClO)}_2 + 2\text{H}_2\text{O}$
第二空
Cl₂的作用分析:
- 氧化剂:Cl₂中的Cl被还原(生成Cl⁻,化合价-1)。
- 还原剂:Cl₂中的Cl被氧化(生成ClO⁻,化合价+1)。
- 结论:Cl₂在反应中既作氧化剂,又作还原剂。