题目
15.已知298 K,101.325kPa下,甲烷的标准摩尔生成焓为 -74.8kJcdot (mol)^-1 ,-|||-固态石墨的原子化焓(即稳定单质变为单个气态原子的焓变)为 cdot (mol)^-1 ,-|||-氢气的原子化焓为 cdot (mol)^-1 ,则 C-H 键的键焓为 () 。-|||-(a) cdot (mol)^-1 (b) cdot (mol)^-1-|||-(c) cdot (mol)^-1 (d) cdot (mol)^-1

题目解答
答案
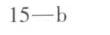
解析
步骤 1:理解键焓和原子化焓的概念
键焓是指在标准状态下,形成1摩尔化学键所释放的能量。原子化焓是指将1摩尔稳定单质转化为气态原子所需要的能量。
步骤 2:写出甲烷生成的热化学方程式
甲烷的生成反应可以表示为:$C(石墨) + 2H_2(g) \rightarrow CH_4(g)$
步骤 3:计算C-H键的键焓
根据键焓和原子化焓的定义,可以得到以下关系式:
$\Delta H_f^{\circ}(CH_4) = \Delta H_{atom}(C) + 2\Delta H_{atom}(H_2) - 4\Delta H_{C-H}$
其中,$\Delta H_f^{\circ}(CH_4)$是甲烷的标准摩尔生成焓,$\Delta H_{atom}(C)$是石墨的原子化焓,$\Delta H_{atom}(H_2)$是氢气的原子化焓,$\Delta H_{C-H}$是C-H键的键焓。
将已知数值代入上述方程,可以得到:
$-74.8 = 717 + 2 \times 218 - 4\Delta H_{C-H}$
解得:$\Delta H_{C-H} = 416 kJ\cdot mol^{-1}$
键焓是指在标准状态下,形成1摩尔化学键所释放的能量。原子化焓是指将1摩尔稳定单质转化为气态原子所需要的能量。
步骤 2:写出甲烷生成的热化学方程式
甲烷的生成反应可以表示为:$C(石墨) + 2H_2(g) \rightarrow CH_4(g)$
步骤 3:计算C-H键的键焓
根据键焓和原子化焓的定义,可以得到以下关系式:
$\Delta H_f^{\circ}(CH_4) = \Delta H_{atom}(C) + 2\Delta H_{atom}(H_2) - 4\Delta H_{C-H}$
其中,$\Delta H_f^{\circ}(CH_4)$是甲烷的标准摩尔生成焓,$\Delta H_{atom}(C)$是石墨的原子化焓,$\Delta H_{atom}(H_2)$是氢气的原子化焓,$\Delta H_{C-H}$是C-H键的键焓。
将已知数值代入上述方程,可以得到:
$-74.8 = 717 + 2 \times 218 - 4\Delta H_{C-H}$
解得:$\Delta H_{C-H} = 416 kJ\cdot mol^{-1}$