题目
A是天然有机高分子化合物,D是一种重要的化工原料,在相同条件下,G的蒸气密度是E的2倍.它们之间的转化关系如图:D 一 E 一 F-|||-H2O G-|||-C-|||-A H2O B 增化茄-|||-H(1)有机物A的化学式为______,F中所含官能团名称______.(2)以烷基铝为催化剂,E能缩合成G,该反应的化学方程式是______.(3)下列说法不正确的是______.A.上述转化关系中加成反应、取代反应、氧化反应B.有机物B、D和E都能使酸性KMnO4溶液褪色C.有机物C、F在浓H2SO4作用下可以制得G,该反应中浓H2SO4是催化剂和吸水剂D.某烃X的相对分子质量是D、H之和,则X能与溴发生加成反应.1、 提出杂化轨道理论的科学家是A.泡利B.洪特C.J·K罗林D.鲍林2、 以下能级符号正确的是A.1p B.2d C.3fD.4s3、 下列说法中正确的是A.处于最低能量的原子叫做基态原子B.3p2表示3p能级有两个轨道C.同一原子中,1s、2s、3s电子的能量逐渐减小D.同一原子中,2p、3p、4p能级的轨道数依次增多4、 人们把电子云轮廓图称为原子轨道,下列说法不正确的是A.s电子的原子轨道都是球形的,2s电子比1s电子能量高且电子云比1s更扩散B.p电子的原子轨道都是哑铃状的,每个p能级有3个原子轨道,它们相互垂直能量相同C.当电子排布在同一能级的不同轨道时,基态原子中的电子总是优先单独占据一个轨道,而且自旋方向相反D.在一个原子轨道里,最多只能容纳2个电子,而且它们的自旋方向相反5、 下列说法中正确的是①在基态多电子原子中,p轨道电子能量一定高于s轨道电子能量②同一周期从左到右,元素的第一电离能、电负性都是越来越大③氮分子的NΞN中有一个σ键,两个π键④所有的配合物都存在配位键,所有含配位键的化合物都是配合物⑤所有含极性键的分子都是极性分子⑥熔融状态下能导电的化合物一定是离子化合物⑦所有的原子晶体都不导电A.①②⑤B.④⑥ C.③⑥ D.③⑦6、 下面有关晶体的叙述中,不正确的是A.金刚石状结构中,由共价键形成的碳原子环中,最小的环上有6个碳原子B.12g石墨中含有σ键的个数为2NA(NA表示阿伏伽德罗常数)C.氯化铯晶体中,每个Cs+周围紧邻8个Cl-D.干冰晶体中,每个CO2分子周围紧邻12个CO2分子7、 现有三种元素的基态原子的电子排布式:①1s22s22p63s23p4;②1s22s22p63s23p3;③ls22s22p5。则下列有关比较中正确的是A.第一电离能:③>②>① B.原子半径:③>②>①C.电负性:③>②>① D.最高正化合价:③>②>①8、 下列各组原子中,彼此化学性质一定相似的是A.原子核外电子排布式为1s2的X原子与原子核外电子排布式为1s22s2的Y原子B.原子核外M层上仅有两个电子的X原子与原子核外N层上仅有两个电子的Y原子C.2p轨道上有一个空轨道的X原子与3P轨道上有一个空轨道的Y原子D.最外层都只有一个电子的X、Y原子9、 下列描述中正确的是A.CS2为V形的极性分子B.ClO3-的空间构型为平面三角形C.SF6中所有原子均满足8电子稳定结构D.SiF4和SO32-的中心原子均为印sp3杂化10、S2Cl2是广泛用于橡胶工业的硫化机,常温下,S2Cl2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体。,S2Cl2的结构与H2O2类似。下列说法不正确的是A. S2Cl2分子中的两个S原子均是sp3杂化B. S2Cl2与H2O反应的化学方程式是:2S2Cl2+2H2O=SO2↑+3S↓+4HC1C.S2Br2与S2Cl2结构相似,熔、沸点:S2Br2> S2Cl2D.S2Cl2是含有极性键和非极性键的非极性分子D 一 E 一 F-|||-H2O G-|||-C-|||-A H2O B 增化茄-|||-H11、具有解热镇痛及抗生素作用的药物“芬必得”主要成分的结构简式如图,它属于①芳香族化合物②烯烃③有机羧酸④有机高分子化合物⑤芳香烃D 一 E 一 F-|||-H2O G-|||-C-|||-A H2O B 增化茄-|||-HA.③⑤B.②③C.①③D.①④12、下列有机物中命名正确的是A. 5—甲基—4一乙基己烷 B. 2, 3—二甲基丁烷C. 3, 3—二甲基一4一乙基戊烷 D. 2, 3, 3—三甲基丁烷13、手性碳原子存在于很多有机化合物中,人们将连有四个不同基团的碳原子形象地成为手性碳原子。下列化合物中含有2个手性碳原子的是A.D 一 E 一 F-|||-H2O G-|||-C-|||-A H2O B 增化茄-|||-HB.D 一 E 一 F-|||-H2O G-|||-C-|||-A H2O B 增化茄-|||-HC.H3CH2COOHD.D 一 E 一 F-|||-H2O G-|||-C-|||-A H2O B 增化茄-|||-H14、烷烃CH3CH2CH(CH2CH2CH3)CH(CH3)CH3的命名正确的是A. 4—甲基—3—丙基戊烷B. 3—异丙基己烷C. 2—甲基—3—丙基戊烷D. 2—甲基—3—乙基己烷15、下列关于有机化合物的说法正确的是A.D 一 E 一 F-|||-H2O G-|||-C-|||-A H2O B 增化茄-|||-H和D 一 E 一 F-|||-H2O G-|||-C-|||-A H2O B 增化茄-|||-H是两种不同的物质B.二氯甲烷属于正四面体的空间结构C.己烷(C6H14)有5种同分异构体D.新戊烷与2, 2—二甲基丙烷的结构不同16、有关有机物D 一 E 一 F-|||-H2O G-|||-C-|||-A H2O B 增化茄-|||-H的下列说法中,不正确的是A.该有机物属于烷烃B.该有机物与3—甲基—5—乙基辛烷互为同系物C.该有机物与2, 5—二甲基一3—乙基己烷互为同分异构体D.该有机物命名时,主链上的碳原子数为6第II卷、(非选择题 共52分)17、(6分)根据要求填空:(1)有机物2,2,3,3一四甲基戊烷的结构简式是__________________(2)草药莪术根茎中有一种色素,用它制成的试纸可以检验溶液的酸碱性。该色素的结构简式为D 一 E 一 F-|||-H2O G-|||-C-|||-A H2O B 增化茄-|||-H该色素一个分子中含有_____个饱和碳原子和____不饱和碳原子,写出该分子中所有官能团的名称______。18、(W分)下表为长式周期表的一部分,其中的编号代表对应的元素。D 一 E 一 F-|||-H2O G-|||-C-|||-A H2O B 增化茄-|||-H(1)写出元素⑤的原子轨道表示式______。⑵写出元素⑨的基态原子的价电子排布式______。(3)表中属于ds区的元素是______(填编号)(4)元素⑩形成的单质是由____键形成的晶体,该晶体采取的堆积方式是_______,晶体中⑩元素原子的配位数是______。(5)元素④、⑤、⑥、⑦的离子半径由小到大的顺序是_______(用离子符号表示)(6)写出元素①和元素⑧形成化合物的电子式______。(7)元素⑨与⑩的第二电离能分别为:I⑨=1753kJ/mo1,I⑩=1959kJ/mo1,第二电离能I⑨(8)科学家发现,②、④、⑨三种元素的原子形成的晶体具有超导性,其晶胞的结构特点如下图所示(图中②、④、⑨分别位于晶胞的体心、顶点、面心),则该化合物的化学式为______(用对应的元素符号表示)。D 一 E 一 F-|||-H2O G-|||-C-|||-A H2O B 增化茄-|||-H19、(6分)A、B、C、D是元素周期表中前四周期的元素,其中A元素p电子总数比s电子总数少1; B元素p电子总数与s电子总数相等,且原子半径比A小;C元素原子3p能级上只有一对成对电子;D元素原子N层上只有1个电子,且次外层的电子充满在2个能级中。请回答以下问题:(1)写出下列元素的名称:A______ D______。(2)元素A、B可以形成A2B型共价化合物,写出一种与A2B等电子体的化合物______(用化学式表示)⑶A和B第一电离能的大小关系为:A____B。(选填“>”、“<”或“ = ”)⑷B和C元素对应的气态氢化物,沸点较髙的是______(填化学式),原因是______。20、(12分)当前材料科学的发展方兴未艾。B、N、Ti、Fe都是重要的材料元素,其单质及化合物在诸多领域中都有广泛的应用。⑴基态Fe2+的电子排布式为______;Ti原子核外共有____种运动状态不同的电子。⑵BF3分子与NH3分子的空间结构分别为____、______;NH3分子是_____分子(填“极性”或“非极性”);BF3与NH3反应生成的BF3·NH3分子中含有的化学键类型有______,在BF3·NH3中B原子的杂化方式为______。⑶N和P同主族。科学家目前合成了N4分子,该分子中N—N键的健角为_______。⑷晶格能:NaN3____KN3(选填“>”、“<”或“ = ”)(5)向硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+配离子,在[Cu(NH3)4]2+中提供孤电子对的成键原子是______。不考虑空间构型,[Cu(NH3)4]2+的结构可用示意图表示为______。己知NF3与NH3具有相同的空间构型,但NF3不易与Cu2+形成配离子,其原因是______。21、(14分)锗(Ge)是典型的半导体元素,在电子、材料等领域应用广泛。回答下列问题:⑴基态Ge原子的核外电子排布式为[Ar]_____,有____个未成对电子。⑵C与Ge是同族元素,C原子之间可以形成双键、叁键,例如乙烯分子中的双键是两个碳原子各用一个____轨道上的电子相互配对形成一个σ键,_____轨道上的电子配对形成一个π键。但Ge原子之间难以形成双键或叁键,从原子结构角度分析,原因是______。⑶比较下列锗卤化物的熔点和沸点,分析其变化规律及原因______。⑷光催化还原CO2制备CH4反应中,带状纳米Zn2GeO4是该反应的良好催化剂,Zn、Ge、O电负性由大至小的顺序是______。(5)Ge单晶具有金刚石型结构,其中Ge原子的杂化方式为_____,微粒之间存在的作用力是______。(6)晶胞有两个基本要素:①原子坐标参数,表示晶胞内部各原子的相对位置。下图为Ge单晶的晶胞,其中原子坐标参数A为(0, 0, 0);B为(1/2, 0 ,1/2);C为(1/2,1/2,0)。则D原子的坐标参数为______。
A是天然有机高分子化合物,D是一种重要的化工原料,在相同条件下,G的蒸气密度是E的2倍.它们之间的转化关系如图:
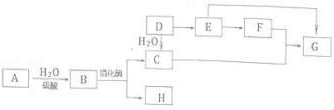
(1)有机物A的化学式为______,F中所含官能团名称______.
(2)以烷基铝为催化剂,E能缩合成G,该反应的化学方程式是______.
(3)下列说法不正确的是______.
A.上述转化关系中加成反应、取代反应、氧化反应
B.有机物B、D和E都能使酸性KMnO4溶液褪色
C.有机物C、F在浓H2SO4作用下可以制得G,该反应中浓H2SO4是催化剂和吸水剂
D.某烃X的相对分子质量是D、H之和,则X能与溴发生加成反应.
1、 提出杂化轨道理论的科学家是
A.泡利B.洪特C.J·K罗林D.鲍林
2、 以下能级符号正确的是
A.1p B.2d C.3fD.4s
3、 下列说法中正确的是
A.处于最低能量的原子叫做基态原子
B.3p2表示3p能级有两个轨道
C.同一原子中,1s、2s、3s电子的能量逐渐减小
D.同一原子中,2p、3p、4p能级的轨道数依次增多
4、 人们把电子云轮廓图称为原子轨道,下列说法不正确的是
A.s电子的原子轨道都是球形的,2s电子比1s电子能量高且电子云比1s更扩散
B.p电子的原子轨道都是哑铃状的,每个p能级有3个原子轨道,它们相互垂直能量相同
C.当电子排布在同一能级的不同轨道时,基态原子中的电子总是优先单独占据一个轨道,而且自旋方向相反
D.在一个原子轨道里,最多只能容纳2个电子,而且它们的自旋方向相反
5、 下列说法中正确的是
①在基态多电子原子中,p轨道电子能量一定高于s轨道电子能量
②同一周期从左到右,元素的第一电离能、电负性都是越来越大
③氮分子的NΞN中有一个σ键,两个π键
④所有的配合物都存在配位键,所有含配位键的化合物都是配合物
⑤所有含极性键的分子都是极性分子
⑥熔融状态下能导电的化合物一定是离子化合物
⑦所有的原子晶体都不导电
A.①②⑤B.④⑥ C.③⑥ D.③⑦
6、 下面有关晶体的叙述中,不正确的是
A.金刚石状结构中,由共价键形成的碳原子环中,最小的环上有6个碳原子
B.12g石墨中含有σ键的个数为2NA(NA表示阿伏伽德罗常数)
C.氯化铯晶体中,每个Cs+周围紧邻8个Cl-
D.干冰晶体中,每个CO2分子周围紧邻12个CO2分子
7、 现有三种元素的基态原子的电子排布式:①1s22s22p63s23p4;②1s22s22p63s23p3;③ls22s22p5。则下列有关比较中正确的是
A.第一电离能:③>②>① B.原子半径:③>②>①
C.电负性:③>②>① D.最高正化合价:③>②>①
8、 下列各组原子中,彼此化学性质一定相似的是
A.原子核外电子排布式为1s2的X原子与原子核外电子排布式为1s22s2的Y原子
B.原子核外M层上仅有两个电子的X原子与原子核外N层上仅有两个电子的Y原子
C.2p轨道上有一个空轨道的X原子与3P轨道上有一个空轨道的Y原子
D.最外层都只有一个电子的X、Y原子
9、 下列描述中正确的是
A.CS2为V形的极性分子
B.ClO3-的空间构型为平面三角形
C.SF6中所有原子均满足8电子稳定结构
D.SiF4和SO32-的中心原子均为印sp3杂化
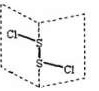
10、S2Cl2是广泛用于橡胶工业的硫化机,常温下,S2Cl2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体。,S2Cl2的结构与H2O2类似。下列说法不正确的是
A. S2Cl2分子中的两个S原子均是sp3杂化
B. S2Cl2与H2O反应的化学方程式是:
2S2Cl2+2H2O=SO2↑+3S↓+4HC1
C.S2Br2与S2Cl2结构相似,熔、沸点:S2Br2> S2Cl2
D.S2Cl2是含有极性键和非极性键的非极性分子
11、具有解热镇痛及抗生素作用的药物“芬必得”主要成分的结构简式如图,它属于①芳香族化合物②烯烃③有机羧酸④有机高分子化合物⑤芳香烃
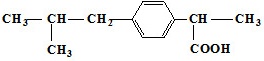
A.③⑤B.②③C.①③D.①④
12、下列有机物中命名正确的是
A. 5—甲基—4一乙基己烷 B. 2, 3—二甲基丁烷
C. 3, 3—二甲基一4一乙基戊烷 D. 2, 3, 3—三甲基丁烷
13、手性碳原子存在于很多有机化合物中,人们将连有四个不同基团的碳原子形象地成为手性碳原子。下列化合物中含有2个手性碳原子的是
A.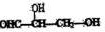 B.
B.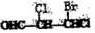
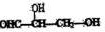 B.
B.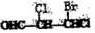
C.H3CH2COOHD.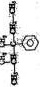

14、烷烃CH3CH2CH(CH2CH2CH3)CH(CH3)CH3的命名正确的是
A. 4—甲基—3—丙基戊烷B. 3—异丙基己烷
C. 2—甲基—3—丙基戊烷D. 2—甲基—3—乙基己烷
15、下列关于有机化合物的说法正确的是
A.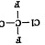 和
和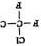 是两种不同的物质
是两种不同的物质
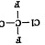 和
和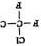 是两种不同的物质
是两种不同的物质B.二氯甲烷属于正四面体的空间结构
C.己烷(C6H14)有5种同分异构体
D.新戊烷与2, 2—二甲基丙烷的结构不同
16、有关有机物 的下列说法中,不正确的是
的下列说法中,不正确的是
 的下列说法中,不正确的是
的下列说法中,不正确的是A.该有机物属于烷烃
B.该有机物与3—甲基—5—乙基辛烷互为同系物
C.该有机物与2, 5—二甲基一3—乙基己烷互为同分异构体
D.该有机物命名时,主链上的碳原子数为6
第II卷、(非选择题 共52分)
17、(6分)根据要求填空:
(1)有机物2,2,3,3一四甲基戊烷的结构简式是__________________
(2)草药莪术根茎中有一种色素,用它制成的试纸可以检验溶液的酸碱性。该色素的结构简式为
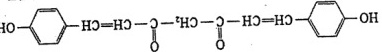
该色素一个分子中含有_____个饱和碳原子和____不饱和碳原子,写出该分子中所有官能团的名称______。
18、(W分)下表为长式周期表的一部分,其中的编号代表对应的元素。
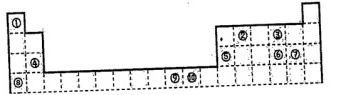
(1)写出元素⑤的原子轨道表示式______。
⑵写出元素⑨的基态原子的价电子排布式______。
(3)表中属于ds区的元素是______(填编号)
(4)元素⑩形成的单质是由____键形成的晶体,该晶体采取的堆积方式是_______,晶体中⑩元素原子的配位数是______。
(5)元素④、⑤、⑥、⑦的离子半径由小到大的顺序是_______(用离子符号表示)
(6)写出元素①和元素⑧形成化合物的电子式______。
(7)元素⑨与⑩的第二电离能分别为:I⑨=1753kJ/mo1,I⑩=1959kJ/mo1,第二电离能I⑨
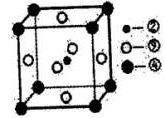
(8)科学家发现,②、④、⑨三种元素的原子形成的晶体具有超导性,其晶胞的结构特点如下图所示(图中②、④、⑨分别位于晶胞的体心、顶点、面心),则该化合物的化学式为______(用对应的元素符号表示)。
19、(6分)A、B、C、D是元素周期表中前四周期的元素,其中A元素p电子总数比s电子总数少1; B元素p电子总数与s电子总数相等,且原子半径比A小;C元素原子3p能级上只有一对成对电子;D元素原子N层上只有1个电子,且次外层的电子充满在2个能级中。请回答以下问题:
(1)写出下列元素的名称:A______ D______。
(2)元素A、B可以形成A2B型共价化合物,写出一种与A2B等电子体的化合物______(用化学式表示)
⑶A和B第一电离能的大小关系为:A____B。(选填“>”、“<”或“ = ”)
⑷B和C元素对应的气态氢化物,沸点较髙的是______(填化学式),原因是______。
20、(12分)当前材料科学的发展方兴未艾。B、N、Ti、Fe都是重要的材料元素,其单质及化合物在诸多领域中都有广泛的应用。
⑴基态Fe2+的电子排布式为______;Ti原子核外共有____种运动状态不同的电子。
⑵BF3分子与NH3分子的空间结构分别为____、______;NH3分子是_____分子(填“极性”或“非极性”);BF3与NH3反应生成的BF3·NH3分子中含有的化学键类型有______,在BF3·NH3中B原子的杂化方式为______。
⑶N和P同主族。科学家目前合成了N4分子,该分子中N—N键的健角为_______。
⑷晶格能:NaN3____KN3(选填“>”、“<”或“ = ”)
(5)向硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+配离子,在[Cu(NH3)4]2+中提供孤电子对的成键原子是______。不考虑空间构型,[Cu(NH3)4]2+的结构可用示意图表示为______。己知NF3与NH3具有相同的空间构型,但NF3不易与Cu2+形成配离子,其原因是______。
21、(14分)
锗(Ge)是典型的半导体元素,在电子、材料等领域应用广泛。回答下列问题:
⑴基态Ge原子的核外电子排布式为[Ar]_____,有____个未成对电子。
⑵C与Ge是同族元素,C原子之间可以形成双键、叁键,例如乙烯分子中的双键是两个碳原子各用一个____轨道上的电子相互配对形成一个σ键,_____轨道上的电子配对形成一个π键。但Ge原子之间难以形成双键或叁键,从原子结构角度分析,原因是______。
⑶比较下列锗卤化物的熔点和沸点,分析其变化规律及原因______。
⑷光催化还原CO2制备CH4反应中,带状纳米Zn2GeO4是该反应的良好催化剂,Zn、Ge、O电负性由大至小的顺序是______。
(5)Ge单晶具有金刚石型结构,其中Ge原子的杂化方式为_____,微粒之间存在的作用力是______。
(6)晶胞有两个基本要素:
①原子坐标参数,表示晶胞内部各原子的相对位置。下图为Ge单晶的晶胞,其中原子坐标参数A为(0, 0, 0);B为(1/2, 0 ,1/2);C为(1/2,1/2,0)。则D原子的坐标参数为______。
题目解答
答案
(C6H10O5)n 羧基 2CH3CHOCH3COOCH2CH3 D