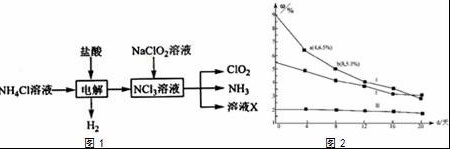
Cl2、ClO2、K2FeO4(高铁酸钾)在生产、生活中广泛用于漂白和杀菌消毒.根据所学知识及实验事实回答下列问题:盐酸 NaClO2溶液-|||-ClO2-|||-NH4Cl溶液 → 电解 NCL溶液 NH3-|||-溶液X-|||-H2-|||-图1-|||-1%-|||-bus-|||-: .-|||-+ + th t "-|||-图2(1)已知高铁酸钾(K2FeO4)具有极强的氧化性,在水溶液中能发生如下反应:4FeO42﹣+10H2O═4Fe(OH)3+8OH﹣+3O2↑.根据此反应可知高铁酸钾在 碱性 的水溶液中比较稳定.(填“酸性”、“中性”或“碱性”)高铁酸钾常见制备方法之一是:在碱性条件下,由Fe(NO3)3与NaClO反应生成,完成并配平该反应的离子方程式:□ClO﹣+□Fe3++□ 10 OH﹣ ═□FeO42﹣+□Cl﹣+□ 5H2O(2)ClO2的氧化性与Cl2相近,在自来水消毒和果蔬保鲜等方面应用广泛.实验室用NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料,通过以下过程制备ClO2:C.氢氟酸保存在磨口试剂瓶中D.液溴密封盛放在无色试剂瓶中,并在液面上放一层水8.卤素单质及化合物在许多性质上都存在着递变规律.下列有关说法不正确的是( )A.卤素单质的沸点按F2、Cl2、Br2、I2的顺序依次增大B.卤素单质与氢气化合按F2、Cl2、Br2、I2的顺序由易变难C.卤化氢的热稳定性和还原性按HF、HCl、HBr、HI的顺序依次减弱D.卤化银的颜色按AgCl、AgBr、AgI 的顺序依次加深9.能正确表示下列反应的离子反应方程式为( )A.大理石溶于醋酸溶液:CaCO3+2H+═Ca2++CO2↑+H2OB.向FeBr2溶液中通入足量氯气:2Fe2++4Br++3Cl2═2Fe3++2Br2+6Cl﹣C.NH4HCO3溶于过量的NaOH溶液中:HCO3﹣+OH﹣═CO32﹣+H2OD.向明矾(KAl(SO4)2•12H2O溶液中滴加Ba(OH)2溶液,恰好使SO42﹣沉淀完全:2Al3++3SO42﹣+3Ba2++6OH﹣═2Al(OH)3↓+3BaSO4↓10.某同学学完《化学1》的知识后得出下列结论,其中正确的是( )A.将NaH溶于水,得到的水溶液能导电,由此可说明NaH是离子化合物B.Fe(OH)3胶体和Fe(OH)3沉淀的物理性质不同但化学性质基本相同C.O2、SO2、SiO2、NO2等都是酸性氧化物;Na2O、MgO、A2lO3等都是碱性氧化物D.MnO2具有较强氧化性,可作为H2O2分解反应的氧化剂11.向1L含Ba(OH)2、NaAlO2均为0.1mol的混合液中逐滴加入0.1mol•L﹣1稀硫酸时,溶液中生成沉淀的物质的量(n)与稀硫酸体积(V)的关系图正确的是( )A.盐酸 NaClO2溶液-|||-ClO2-|||-NH4Cl溶液 → 电解 NCL溶液 NH3-|||-溶液X-|||-H2-|||-图1-|||-1%-|||-bus-|||-: .-|||-+ + th t "-|||-图2 B.盐酸 NaClO2溶液-|||-ClO2-|||-NH4Cl溶液 → 电解 NCL溶液 NH3-|||-溶液X-|||-H2-|||-图1-|||-1%-|||-bus-|||-: .-|||-+ + th t "-|||-图2 C.盐酸 NaClO2溶液-|||-ClO2-|||-NH4Cl溶液 → 电解 NCL溶液 NH3-|||-溶液X-|||-H2-|||-图1-|||-1%-|||-bus-|||-: .-|||-+ + th t "-|||-图2 D.盐酸 NaClO2溶液-|||-ClO2-|||-NH4Cl溶液 → 电解 NCL溶液 NH3-|||-溶液X-|||-H2-|||-图1-|||-1%-|||-bus-|||-: .-|||-+ + th t "-|||-图212.用下列实验装置和方法进行相应实验,能达到实验目的是( )A.盐酸 NaClO2溶液-|||-ClO2-|||-NH4Cl溶液 → 电解 NCL溶液 NH3-|||-溶液X-|||-H2-|||-图1-|||-1%-|||-bus-|||-: .-|||-+ + th t "-|||-图2用图装置除去Cl2中混有的少量HClB.盐酸 NaClO2溶液-|||-ClO2-|||-NH4Cl溶液 → 电解 NCL溶液 NH3-|||-溶液X-|||-H2-|||-图1-|||-1%-|||-bus-|||-: .-|||-+ + th t "-|||-图2用图装置分离水和溴苯的混合物C.盐酸 NaClO2溶液-|||-ClO2-|||-NH4Cl溶液 → 电解 NCL溶液 NH3-|||-溶液X-|||-H2-|||-图1-|||-1%-|||-bus-|||-: .-|||-+ + th t "-|||-图2用图装置制备并收集NO气体[注:NCl3中N元素为﹣3价,Cl为+1价]请仔细分析图1中物质的转化关系,结合氧化还原反应规律完成下面2小题①电解时发生反应的化学方程式为 NH4Cl+2HCl盐酸 NaClO2溶液-|||-ClO2-|||-NH4Cl溶液 → 电解 NCL溶液 NH3-|||-溶液X-|||-H2-|||-图1-|||-1%-|||-bus-|||-: .-|||-+ + th t "-|||-图23H2↑+NCl3 .②溶液X中大量存在的两种阴离子是 Cl﹣、OH﹣ .(3)①用烧碱溶液吸收Cl2可制得漂白液,据此判断漂白液的有效成分为 NaClO ;②研究漂白液的稳定性对其生产和保存有实际意义.30℃时,pH=11的不同浓度的三份漂白液中有效成分的质量分数ω随时间变化如图2:分解速率v( I)、v(Ⅱ)的大小关系是 v(I)>v(Ⅱ) ,其原因是 在相同条件下,次氯酸钠的浓度越高其分解速率越大 .
Cl2、ClO2、K2FeO4(高铁酸钾)在生产、生活中广泛用于漂白和杀菌消毒.根据所学知识及实验事实回答下列问题:
(1)已知高铁酸钾(K2FeO4)具有极强的氧化性,在水溶液中能发生如下反应:4FeO42﹣+10H2O═4Fe(OH)3+8OH﹣+3O2↑.根据此反应可知高铁酸钾在 碱性 的水溶液中比较稳定.(填“酸性”、“中性”或“碱性”)
高铁酸钾常见制备方法之一是:在碱性条件下,由Fe(NO3)3与NaClO反应生成,完成并配平该反应的离子方程式:□ClO﹣+□Fe3++□ 10 OH﹣ ═□FeO42﹣+□Cl﹣+□ 5H2O
(2)ClO2的氧化性与Cl2相近,在自来水消毒和果蔬保鲜等方面应用广泛.实验室用NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料,通过以下过程制备ClO2:
C.氢氟酸保存在磨口试剂瓶中
D.液溴密封盛放在无色试剂瓶中,并在液面上放一层水
8.卤素单质及化合物在许多性质上都存在着递变规律.下列有关说法不正确的是( )
A.卤素单质的沸点按F2、Cl2、Br2、I2的顺序依次增大
B.卤素单质与氢气化合按F2、Cl2、Br2、I2的顺序由易变难
C.卤化氢的热稳定性和还原性按HF、HCl、HBr、HI的顺序依次减弱
D.卤化银的颜色按AgCl、AgBr、AgI 的顺序依次加深
9.能正确表示下列反应的离子反应方程式为( )
A.大理石溶于醋酸溶液:CaCO3+2H+═Ca2++CO2↑+H2O
B.向FeBr2溶液中通入足量氯气:2Fe2++4Br++3Cl2═2Fe3++2Br2+6Cl﹣
C.NH4HCO3溶于过量的NaOH溶液中:HCO3﹣+OH﹣═CO32﹣+H2O
D.向明矾(KAl(SO4)2•12H2O溶液中滴加Ba(OH)2溶液,恰好使SO42﹣沉淀完全:2Al3++3SO42﹣+3Ba2++6OH﹣═2Al(OH)3↓+3BaSO4↓
10.某同学学完《化学1》的知识后得出下列结论,其中正确的是( )
A.将NaH溶于水,得到的水溶液能导电,由此可说明NaH是离子化合物
B.Fe(OH)3胶体和Fe(OH)3沉淀的物理性质不同但化学性质基本相同
C.O2、SO2、SiO2、NO2等都是酸性氧化物;Na2O、MgO、A2lO3等都是碱性氧化物
D.MnO2具有较强氧化性,可作为H2O2分解反应的氧化剂
11.向1L含Ba(OH)2、NaAlO2均为0.1mol的混合液中逐滴加入0.1mol•L﹣1稀硫酸时,溶液中生成沉淀的物质的量(n)与稀硫酸体积(V)的关系图正确的是( )
A.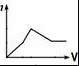 B.
B.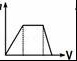 C.
C.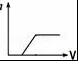 D.
D.
12.用下列实验装置和方法进行相应实验,能达到实验目的是( )
A.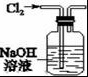
用图装置除去Cl2中混有的少量HCl
B.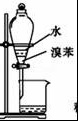
用图装置分离水和溴苯的混合物
C.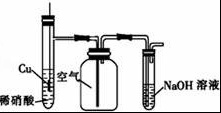
用图装置制备并收集NO气体
[注:NCl3中N元素为﹣3价,Cl为+1价]
请仔细分析图1中物质的转化关系,结合氧化还原反应规律完成下面2小题
①电解时发生反应的化学方程式为 NH4Cl+2HCl 3H2↑+NCl3 .
3H2↑+NCl3 .
②溶液X中大量存在的两种阴离子是 Cl﹣、OH﹣ .
(3)①用烧碱溶液吸收Cl2可制得漂白液,据此判断漂白液的有效成分为 NaClO ;
②研究漂白液的稳定性对其生产和保存有实际意义.30℃时,pH=11的不同浓度的三份漂白液中有效成分的质量分数ω随时间变化如图2:分解速率v( I)、v(Ⅱ)的大小关系是 v(I)>v(Ⅱ) ,其原因是 在相同条件下,次氯酸钠的浓度越高其分解速率越大 .
题目解答
答案
[解答]解:(1)由4FeO42﹣+10H2O═4Fe(OH)3+8OH﹣+3O2↑可知,碱性溶液在可抑制高铁酸钾与水反应,则在碱性溶液中可稳定存在;ClO﹣+□Fe3+═□FeO42﹣+□Cl﹣中,Cl元素的化合价降低,Fe元素的化合价升高,由电子、电荷及原子守恒可知,离子反应为3ClO﹣+2Fe3++10 OH﹣=2FeO42﹣+3Cl﹣+5H2O,
故答案为:碱性;3;2;10 OH﹣;2;3;5H2O;
(2)实验室用NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料,通过以下过程制备ClO2,由转化图可知,电解生成氢气、NCl3;NCl3与NaClO2反应生成ClO2、NH3,则反应物中有水参加反应,生成物中X含NaOH、NaCl,
①电解时发生反应的化学方程式为NH4Cl+2HCl 3H2↑+NCl3,故答案为:NH4Cl+2HCl
3H2↑+NCl3,故答案为:NH4Cl+2HCl 3H2↑+NCl3;
3H2↑+NCl3;
②X含NaOH、NaCl,溶液X中大量存在的两种阴离子是Cl﹣、OH﹣,故答案为:Cl﹣、OH﹣;
(3)①用烧碱溶液吸收Cl2可制得漂白液,反应生成NaCl、NaClO,NaClO具有强氧化性,漂白液的有效成分为NaClO,故答案为:NaClO;
②由30℃时,pH=11的不同浓度的三份漂白液中有效成分的质量分数ω随时间变化图可知,在相同条件下,次氯酸钠的浓度越高其分解速率越大,则分解速率v(I)>v(Ⅱ),故答案为:v(I)>v(Ⅱ);在相同条件下,次氯酸钠的浓度越高其分解速率越大.