题目
短周期主族元素W、X、Y、Z的原子序数依次增大,W的简单氢化物可用作制冷剂,Y的原子半径是所有短周期主族元素中最大的。由X、Y和Z三种元素形成的一种盐溶于水后,加入稀盐酸,有黄色沉淀析出,同时有刺激性气体产生。下列说法不正确的是 A. X的简单氢化物的热稳定性比W强 B. Y的简单离子与X的具有相同的电子层结构 C. Y与Z形成化合物的水溶液可使蓝色石蕊试纸变红 D. Z与X属于同一主族,与Y属于同一周期 E. [解答] A.非金属性,气态氢化物的稳定性:,故A正确; B.H与F、Cl等形成共价化合物,与Na等形成离子化合物,则氢元素与其他元素可形成共价化合物或离子化合物,故B正确; C.利用最高价含氧酸的酸性比较非金属性,HCl不是最高价含氧酸,则不能比较Cl、C的非金属性,故C错误; D.目前周期表中112号元素位于第七周期的IIB族,118号元素的原子结构中有7个电子层、最外层电子数为8,则118号元素在周期表中位于第七周期0族,故D正确; 故选:C。 9.[答案]D F. [解答] X、Y、Z、W、R属于短周期主族元素,X的原子半径是短周期主族元素中最大的,则X为Na元素;Z元素的原子L层电子数为,M层电子数为,则且,Y元素的原子最外层电子数为m,次外层电子数为n,次外层为K层,则,所以,则Y是O元素、Z为Si元素;W元素与Z元素同主族,则W为C元素;R元素原子与Y元素原子的核外电子数之比为2:1,则R原子核外有16个电子,为S元素,所以X、Y、Z、W、R分别是Na、O、Si、C、S元素,据此解答。 A.X和Y可以形成两种离子化合物,分别为、,其阴阳离子个数之比都是1:2,故A正确; B.元素的非金属性越强,其氢化物越稳定,氢化物的熔沸点与分子间作用力成正比,含有氢键的氢化物熔沸点较高,非金属性,所以氢化物的热稳定性,O的氢化物中含有氢键、S的氢化物中不含氢键,所以氢化物的熔沸点:,故B正确; C.元素的非金属性越强,其最高价氧化物的水化物酸性越强,非金属性,所以最高价氧化物对应水化物的酸性强弱顺序是:,故C正确; D.和溶液发生氧化还原反应生成硫酸钡白色沉淀,碳酸酸性小于硝酸,所以和溶液不反应,没有明显现象,故D错误。 故选D。 10.[答案]D G. [解析]解:由以上分析可知X为O、Y为Al、Z为Cl、W为N元素, A.W为N元素,对应的氢化物分子之间可形成氢键,沸点比HCl高,故A错误; B.Y为Al,对应的氧化物的水化物呈碱性,W为N,对应的氧化物的水化物溶液呈酸性,故B错误; C.离子化合物,为共价化合物,则离子化合物的熔点较高,故C错误; D.X为O、Y为Al,对应的离子具有相同的核外电子排布,核电荷数越大离子半径越小,故D正确。 故选:D。 由元素在周期表中的位置可知W、X为第二周期,Y、Z为第三周期,设Y的最外层电子数为n,则W的最外层电子数为、X的最外层电子数为、Z的最外层电子数为,则,,,则Y为Al元素,W为N元素,X为O元素,Z为Cl元素,结合对应单质、化合物的性质以及元素周期律知识解答该题。 11.[答案]D [解答] 短周期主族元素X、Y、Z、W的原子序数依次增大,X原子核外最外层电子数是其电子层数的2倍,则X为C元素,X、Y的核电荷数之比为3:4,则Y为O元素,的最外层为8电子结构,W为F或Cl元素,金属单质Z在空气中燃烧生成的化合物可与水发生氧化还原反应,则Z为Na元素,W只能为Cl元素, A.X与Y形成的化合物有CO、等,Z的最高价氧化物的水化物为NaOH,CO和NaOH不反应,故A错误; B.一般说来,电子层数越多,原子半径越大,电子层数相同,质子数越多,半径越小,则原子半径大小,,故B错误; C.化合物和分别为、,存在离子键和共价键,故C错误; D.Y的单质臭氧,W的单质氯气,对应的化合物,可作为水的消毒剂,故D正确。 故选D。 12.[答案]B [解答] A、B、C、D、E均为短周期主族元素,原子序数均小于18,A是短周期中原子半径最小的元素,A是氢元素,E是短周期中最活泼的金属元素,所以E为钠元素,由B与C、D在周期表中的位置关系可知,B、C位于第二周期,原子序数:,且C与D处于同主族,A、B、C三种元素的原子序数之和等于D元素的原子序数,令C的原子序数为x,则B为、D为,则,解得,故A为H、B为N、C为O、D为S,E为Na, A.B为N、C为O、E为Na,电子层结构相同核电荷数越大离子半径越小,则离子半径,故A正确; B.氢键不影响氢化物的稳定性。同一主族元素中,元素的非金属性随着原子序数的增大而减小,元素的非金属性越强,其氢化物的稳定性越强,非金属性,所以氢化物稳定性,故B错误; C.是由铵根离子和氢负离子,一个铵根离子带一个单位的正电荷,一个氢负离子带一个单位的负电荷,所以阴、阳离子个数比为,故C正确; D.由C、D、E三种元素组成的某种化合物可能为硫酸钠、亚硫酸钠、硫代硫酸钠,,故D正确; 故选B。 13.[答案]B [解答] A.与氢氟酸反应不生成盐和水,虽然既能与氢氟酸反应又能与NaOH溶液反应,但是不是两性氧化物,是酸性氧化物,故A错误; B.常温下,溶解度比小,往饱和溶液中通入有碳酸氢钠晶体析出,是因为反应会消耗水,同时碳酸钠溶解度大于碳酸氢钠的原因,故B正确; C.气体通入溶液中产生沉淀是硫酸钡不是亚硫酸钡,是二氧化硫与水反应产生亚硫酸显酸性,溶液中又有硝酸根离子会氧化亚硫酸为硫酸根离子,故C错误; D.非金属性:,可比较最高价氧化物水化物的酸性,陈述Ⅰ正确,Ⅱ错,且不存在因果关系,故D错误。 故选B。 14.[答案]C [解答] A.为共价化合物,其电子式为;由于非金属性,所以磷化氢的热稳定性不如,故A正确; B.中硫原子核外达到8电子稳定结构,其电子式为,离子中硫氢键为极性共价键,硫氢根离子为18电子的粒子,故B正确; C.为共价化合物,其电子式为,是分子结构呈四面体的分子,故C错误; D.氟化钾为离子化合物,电子式中需要标出离子所带的电荷,其电子式为:,氟化钾易溶于水,故D正确; 故选:C。 15.[答案]C [解答] A.B为C元素,在自然界存在多种同位素,如C、等,故A错误; B.元素C、D、E的简单离子中C、D有两个电子层,E有3个电子层,E的离子的半径最大,故B错误; C.A、E分别与C形成的化合物分别为NaH、NaCl,都含有离子键,故C正确; D.Cl的非金属性大于C,对应的简单离子C的还原性较强,故D错误。 故选C。 16.[答案]D [解答] 短周期主族元素中,R原子最外层电子数是电子层数的2倍,可能为C元素或S元素,由图中原子半径和原子序数关系可知R应为C元素;Y与Z能形成、型离子化合物,应为、,则Y为O,Z为Na元素;Y与T同主族,则T应为S元素,X的原子半径最小,原子序数最小,则X为H元素。 A.离子电子层结构相同,核电荷数越大离子半径越小,则离子半径,故A错误; B.非金属性,故氢化物稳定性:,故B错误; C.非金属性,元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,故C错误; D.由H、O、Na、C四种元素组成的化合物为等,含有离子键,故D正确。 故选D。 17.[答案]B [解答] A.比较Cl的非金属性应选择其最高价含氧酸,盐酸易挥发,能与硅酸钠反应生成硅酸沉淀,图中装置不能说明碳酸的酸性大于硅酸,则不能比较非金属性,故A错误; B.四氯化碳的密度比水大,不溶于水,可使气体与水隔离,从而可防止倒吸,故B正确; C.二氧化氮与水反应,不能利用排水法收集,故C错误; D.过氧化钠为粉末固体,隔板不能使固体与液体分离,则图中装置不能用于制备少量氧气,故D错误。 故选B。
短周期主族元素W、X、Y、Z的原子序数依次增大,W的简单氢化物可用作制冷剂,Y的原子半径是所有短周期主族元素中最大的。由X、Y和Z三种元素形成的一种盐溶于水后,加入稀盐酸,有黄色沉淀析出,同时有刺激性气体产生。下列说法不正确的是
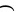
B. Y的简单离子与X的具有相同的电子层结构
C. Y与Z形成化合物的水溶液可使蓝色石蕊试纸变红
D. Z与X属于同一主族,与Y属于同一周期
E. [解答] A.非金属性
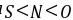 ,气态氢化物的稳定性:
,气态氢化物的稳定性: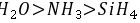 ,故A正确; B.H与F、Cl等形成共价化合物,与Na等形成离子化合物,则氢元素与其他元素可形成共价化合物或离子化合物,故B正确; C.利用最高价含氧酸的酸性比较非金属性,HCl不是最高价含氧酸,则不能比较Cl、C的非金属性,故C错误; D.目前周期表中112号元素位于第七周期的IIB族,118号元素的原子结构中有7个电子层、最外层电子数为8,则118号元素在周期表中位于第七周期0族,故D正确; 故选:C。 9.[答案]D
,故A正确; B.H与F、Cl等形成共价化合物,与Na等形成离子化合物,则氢元素与其他元素可形成共价化合物或离子化合物,故B正确; C.利用最高价含氧酸的酸性比较非金属性,HCl不是最高价含氧酸,则不能比较Cl、C的非金属性,故C错误; D.目前周期表中112号元素位于第七周期的IIB族,118号元素的原子结构中有7个电子层、最外层电子数为8,则118号元素在周期表中位于第七周期0族,故D正确; 故选:C。 9.[答案]DF. [解答] X、Y、Z、W、R属于短周期主族元素,X的原子半径是短周期主族元素中最大的,则X为Na元素;Z元素的原子L层电子数为
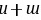 ,M层电子数为
,M层电子数为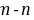 ,则
,则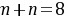 且
且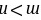 ,Y元素的原子最外层电子数为m,次外层电子数为n,次外层为K层,则
,Y元素的原子最外层电子数为m,次外层电子数为n,次外层为K层,则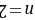 ,所以
,所以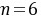 ,则Y是O元素、Z为Si元素;W元素与Z元素同主族,则W为C元素;R元素原子与Y元素原子的核外电子数之比为2:1,则R原子核外有16个电子,为S元素,所以X、Y、Z、W、R分别是Na、O、Si、C、S元素,据此解答。 A.X和Y可以形成两种离子化合物,分别为
,则Y是O元素、Z为Si元素;W元素与Z元素同主族,则W为C元素;R元素原子与Y元素原子的核外电子数之比为2:1,则R原子核外有16个电子,为S元素,所以X、Y、Z、W、R分别是Na、O、Si、C、S元素,据此解答。 A.X和Y可以形成两种离子化合物,分别为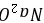 、
、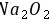 ,其阴阳离子个数之比都是1:2,故A正确; B.元素的非金属性越强,其氢化物越稳定,氢化物的熔沸点与分子间作用力成正比,含有氢键的氢化物熔沸点较高,非金属性
,其阴阳离子个数之比都是1:2,故A正确; B.元素的非金属性越强,其氢化物越稳定,氢化物的熔沸点与分子间作用力成正比,含有氢键的氢化物熔沸点较高,非金属性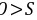 ,所以氢化物的热稳定性
,所以氢化物的热稳定性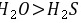 ,O的氢化物中含有氢键、S的氢化物中不含氢键,所以氢化物的熔沸点:
,O的氢化物中含有氢键、S的氢化物中不含氢键,所以氢化物的熔沸点: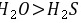 ,故B正确; C.元素的非金属性越强,其最高价氧化物的水化物酸性越强,非金属性
,故B正确; C.元素的非金属性越强,其最高价氧化物的水化物酸性越强,非金属性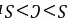 ,所以最高价氧化物对应水化物的酸性强弱顺序是:
,所以最高价氧化物对应水化物的酸性强弱顺序是: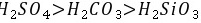 ,故C正确; D.
,故C正确; D.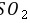 和
和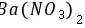 溶液发生氧化还原反应生成硫酸钡白色沉淀,碳酸酸性小于硝酸,所以
溶液发生氧化还原反应生成硫酸钡白色沉淀,碳酸酸性小于硝酸,所以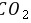 和
和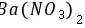 溶液不反应,没有明显现象,故D错误。 故选D。 10.[答案]D
溶液不反应,没有明显现象,故D错误。 故选D。 10.[答案]DG. [解析]解:由以上分析可知X为O、Y为Al、Z为Cl、W为N元素, A.W为N元素,对应的氢化物分子之间可形成氢键,沸点比HCl高,故A错误; B.Y为Al,对应的氧化物的水化物呈碱性,W为N,对应的氧化物的水化物溶液呈酸性,故B错误; C.
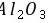 离子化合物,
离子化合物,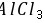 为共价化合物,则离子化合物的熔点较高,故C错误; D.X为O、Y为Al,对应的离子具有相同的核外电子排布,核电荷数越大离子半径越小,故D正确。 故选:D。 由元素在周期表中的位置可知W、X为第二周期,Y、Z为第三周期,设Y的最外层电子数为n,则W的最外层电子数为
为共价化合物,则离子化合物的熔点较高,故C错误; D.X为O、Y为Al,对应的离子具有相同的核外电子排布,核电荷数越大离子半径越小,故D正确。 故选:D。 由元素在周期表中的位置可知W、X为第二周期,Y、Z为第三周期,设Y的最外层电子数为n,则W的最外层电子数为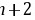 、X的最外层电子数为
、X的最外层电子数为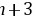 、Z的最外层电子数为
、Z的最外层电子数为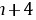 ,则
,则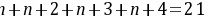 ,
,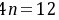 ,
,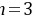 ,则Y为Al元素,W为N元素,X为O元素,Z为Cl元素,结合对应单质、化合物的性质以及元素周期律知识解答该题。 11.[答案]D
,则Y为Al元素,W为N元素,X为O元素,Z为Cl元素,结合对应单质、化合物的性质以及元素周期律知识解答该题。 11.[答案]D[解答] 短周期主族元素X、Y、Z、W的原子序数依次增大,X原子核外最外层电子数是其电子层数的2倍,则X为C元素,X、Y的核电荷数之比为3:4,则Y为O元素,
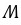 的最外层为8电子结构,W为F或Cl元素,金属单质Z在空气中燃烧生成的化合物可与水发生氧化还原反应,则Z为Na元素,W只能为Cl元素, A.X与Y形成的化合物有CO、
的最外层为8电子结构,W为F或Cl元素,金属单质Z在空气中燃烧生成的化合物可与水发生氧化还原反应,则Z为Na元素,W只能为Cl元素, A.X与Y形成的化合物有CO、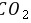 等,Z的最高价氧化物的水化物为NaOH,CO和NaOH不反应,故A错误; B.一般说来,电子层数越多,原子半径越大,电子层数相同,质子数越多,半径越小,则原子半径大小
等,Z的最高价氧化物的水化物为NaOH,CO和NaOH不反应,故A错误; B.一般说来,电子层数越多,原子半径越大,电子层数相同,质子数越多,半径越小,则原子半径大小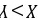 ,
,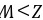 ,故B错误; C.化合物
,故B错误; C.化合物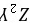 和
和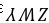 分别为
分别为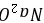 、
、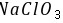 ,
,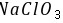 存在离子键和共价键,故C错误; D.Y的单质臭氧,W的单质氯气,对应的化合物
存在离子键和共价键,故C错误; D.Y的单质臭氧,W的单质氯气,对应的化合物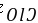 ,可作为水的消毒剂,故D正确。 故选D。 12.[答案]B
,可作为水的消毒剂,故D正确。 故选D。 12.[答案]B[解答] A、B、C、D、E均为短周期主族元素,原子序数均小于18,A是短周期中原子半径最小的元素,A是氢元素,E是短周期中最活泼的金属元素,所以E为钠元素,由B与C、D在周期表中的位置关系可知,B、C位于第二周期,原子序数:
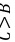 ,且C与D处于同主族,A、B、C三种元素的原子序数之和等于D元素的原子序数,令C的原子序数为x,则B为
,且C与D处于同主族,A、B、C三种元素的原子序数之和等于D元素的原子序数,令C的原子序数为x,则B为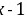 、D为
、D为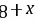 ,则
,则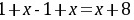 ,解得
,解得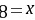 ,故A为H、B为N、C为O、D为S,E为Na, A.B为N、C为O、E为Na,电子层结构相同核电荷数越大离子半径越小,则离子半径
,故A为H、B为N、C为O、D为S,E为Na, A.B为N、C为O、E为Na,电子层结构相同核电荷数越大离子半径越小,则离子半径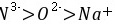 ,故A正确; B.氢键不影响氢化物的稳定性。同一主族元素中,元素的非金属性随着原子序数的增大而减小,元素的非金属性越强,其氢化物的稳定性越强,非金属性
,故A正确; B.氢键不影响氢化物的稳定性。同一主族元素中,元素的非金属性随着原子序数的增大而减小,元素的非金属性越强,其氢化物的稳定性越强,非金属性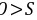 ,所以氢化物稳定性
,所以氢化物稳定性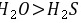 ,故B错误; C.
,故B错误; C.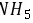 是由铵根离子和氢负离子,一个铵根离子带一个单位的正电荷,一个氢负离子带一个单位的负电荷,所以阴、阳离子个数比为
是由铵根离子和氢负离子,一个铵根离子带一个单位的正电荷,一个氢负离子带一个单位的负电荷,所以阴、阳离子个数比为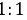 ,故C正确; D.由C、D、E三种元素组成的某种化合物可能为硫酸钠、亚硫酸钠、硫代硫酸钠,
,故C正确; D.由C、D、E三种元素组成的某种化合物可能为硫酸钠、亚硫酸钠、硫代硫酸钠,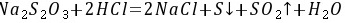 ,故D正确; 故选B。 13.[答案]B
,故D正确; 故选B。 13.[答案]B[解答] A.
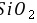 与氢氟酸反应不生成盐和水,虽然
与氢氟酸反应不生成盐和水,虽然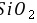 既能与氢氟酸反应又能与NaOH溶液反应,但是
既能与氢氟酸反应又能与NaOH溶液反应,但是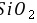 不是两性氧化物,是酸性氧化物,故A错误; B.常温下,
不是两性氧化物,是酸性氧化物,故A错误; B.常温下,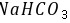 溶解度比
溶解度比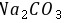 小,往饱和
小,往饱和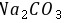 溶液中通入
溶液中通入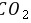 有碳酸氢钠晶体析出,是因为反应会消耗水,同时碳酸钠溶解度大于碳酸氢钠的原因,故B正确; C.
有碳酸氢钠晶体析出,是因为反应会消耗水,同时碳酸钠溶解度大于碳酸氢钠的原因,故B正确; C.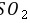 气体通入
气体通入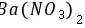 溶液中产生沉淀是硫酸钡不是亚硫酸钡,是二氧化硫与水反应产生亚硫酸显酸性,溶液中又有硝酸根离子会氧化亚硫酸为硫酸根离子,故C错误; D.非金属性:
溶液中产生沉淀是硫酸钡不是亚硫酸钡,是二氧化硫与水反应产生亚硫酸显酸性,溶液中又有硝酸根离子会氧化亚硫酸为硫酸根离子,故C错误; D.非金属性: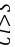 ,可比较最高价氧化物水化物的酸性,陈述Ⅰ正确,Ⅱ错,且不存在因果关系,故D错误。 故选B。 14.[答案]C
,可比较最高价氧化物水化物的酸性,陈述Ⅰ正确,Ⅱ错,且不存在因果关系,故D错误。 故选B。 14.[答案]C[解答] A.
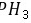 为共价化合物,其电子式为
为共价化合物,其电子式为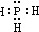 ;由于非金属性
;由于非金属性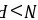 ,所以磷化氢的热稳定性不如
,所以磷化氢的热稳定性不如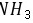 ,故A正确; B.
,故A正确; B.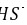 中硫原子核外达到8电子稳定结构,其电子式为
中硫原子核外达到8电子稳定结构,其电子式为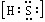 ,离子中硫氢键为极性共价键,硫氢根离子为18电子的粒子,故B正确; C.
,离子中硫氢键为极性共价键,硫氢根离子为18电子的粒子,故B正确; C.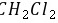 为共价化合物,其电子式为
为共价化合物,其电子式为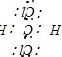 ,是分子结构呈四面体的分子,故C错误; D.氟化钾为离子化合物,电子式中需要标出离子所带的电荷,其电子式为:
,是分子结构呈四面体的分子,故C错误; D.氟化钾为离子化合物,电子式中需要标出离子所带的电荷,其电子式为: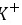
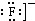 ,氟化钾易溶于水,故D正确; 故选:C。 15.[答案]C
,氟化钾易溶于水,故D正确; 故选:C。 15.[答案]C[解答] A.B为C元素,在自然界存在多种同位素,如
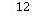 C、
C、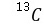 等,故A错误; B.元素C、D、E的简单离子中C、D有两个电子层,E有3个电子层,E的离子的半径最大,故B错误; C.A、E分别与C形成的化合物分别为NaH、NaCl,都含有离子键,故C正确; D.Cl的非金属性大于C,对应的简单离子C的还原性较强,故D错误。 故选C。 16.[答案]D
等,故A错误; B.元素C、D、E的简单离子中C、D有两个电子层,E有3个电子层,E的离子的半径最大,故B错误; C.A、E分别与C形成的化合物分别为NaH、NaCl,都含有离子键,故C正确; D.Cl的非金属性大于C,对应的简单离子C的还原性较强,故D错误。 故选C。 16.[答案]D[解答] 短周期主族元素中,R原子最外层电子数是电子层数的2倍,可能为C元素或S元素,由图中原子半径和原子序数关系可知R应为C元素;Y与Z能形成
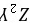 、
、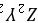 型离子化合物,应为
型离子化合物,应为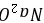 、
、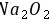 ,则Y为O,Z为Na元素;Y与T同主族,则T应为S元素,X的原子半径最小,原子序数最小,则X为H元素。 A.离子电子层结构相同,核电荷数越大离子半径越小,则离子半径
,则Y为O,Z为Na元素;Y与T同主族,则T应为S元素,X的原子半径最小,原子序数最小,则X为H元素。 A.离子电子层结构相同,核电荷数越大离子半径越小,则离子半径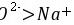 ,故A错误; B.非金属性
,故A错误; B.非金属性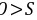 ,故氢化物稳定性:
,故氢化物稳定性: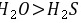 ,故B错误; C.非金属性
,故B错误; C.非金属性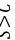 ,元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,故C错误; D.由H、O、Na、C四种元素组成的化合物为
,元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,故C错误; D.由H、O、Na、C四种元素组成的化合物为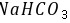 等,含有离子键,故D正确。 故选D。 17.[答案]B
等,含有离子键,故D正确。 故选D。 17.[答案]B[解答] A.比较Cl的非金属性应选择其最高价含氧酸
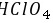 ,盐酸易挥发,能与硅酸钠反应生成硅酸沉淀,图中装置不能说明碳酸的酸性大于硅酸,则不能比较非金属性,故A错误; B.四氯化碳的密度比水大,不溶于水,可使气体与水隔离,从而可防止倒吸,故B正确; C.二氧化氮与水反应,不能利用排水法收集,故C错误; D.过氧化钠为粉末固体,隔板不能使固体与液体分离,则图中装置不能用于制备少量氧气,故D错误。 故选B。
,盐酸易挥发,能与硅酸钠反应生成硅酸沉淀,图中装置不能说明碳酸的酸性大于硅酸,则不能比较非金属性,故A错误; B.四氯化碳的密度比水大,不溶于水,可使气体与水隔离,从而可防止倒吸,故B正确; C.二氧化氮与水反应,不能利用排水法收集,故C错误; D.过氧化钠为粉末固体,隔板不能使固体与液体分离,则图中装置不能用于制备少量氧气,故D错误。 故选B。题目解答
答案
9. 【答案】 10. 【答案】 【解析】 1 1 . 【答案】 1 2 . 【答案】 1 3 . 【答案】 1 4 . 【答案】 1 5 . 【答案】 1 6 . 【答案】 1 7 . 【答案】