(13分)(2014春•延边州校级期中)氮化硼(BN)是一种重要的功能陶瓷材料.以天然硼砂为起始物,经过一系列反应可以得到BF3和BN,请回答下列问题(1)基态B原子的电子排布式为 1s22s22p1 ;B和N相比,电负性较大的是 N ,BN中B元素的化合价为 +3 ;(2)在BF3分子中,F﹣B﹣F的键角是 120° ,B原子的杂化轨道类型为 sp2 ,BF3和过量NaF作用可生成NaBF4,BF4﹣的立体结构为 正四面体 ;(3)在与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的化学键为 极性键 ,层间作用力为 分子间作用力 ; A.SO2和SiO2B.NaCl和HClC.CCl4和KClD.CO2和H2O10.(1分)(2014春•兰州校级期中)下列说法不正确的是( ) A.互为同分异构体的分子结构几乎完全相同 B.丙氨酸CH3﹣CH(NH2)﹣COOH存在手性异构体 C.标准状况下,相同体积的NH3、CH4、HF含有相同的电子数 D.等体积的CO和N2混合后所得的混合气体的平均摩尔质量为28 g/mol11.(2分)(2012春•泰安期末)右表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( )x-|||-W Y R-|||-z A.常压下五种元素的单质中,Z单质的沸点最高 B.Y、Z的阴离子电子层结构都与R原子的相同 C.W的氢化物的沸点比X的氢化物的沸点高 D.Y元素的非金属性比W元素的非金属性强12.(2分)(2014春•兰州校级期中)下列各项比较中前者高于(或大于或强于)后者的是( ) A.CCl4和SiCl4的熔点 B.邻羟基苯甲醛()和对羟基苯甲醛()的沸点 C.SO2和CO2在水中的溶解度 D.H2SO3和H2SO4的酸性13.(2分)(2015春•新疆校级期中)下列描述中正确的是( ) A.CS2为V形的极性分子 B.ClO3﹣的空间构型为平面三角形 C.SF6中的空间构型为正四面体形 D.SiF4和SO32﹣的中心原子均为sp3杂化14.(2分)(2014春•兰州校级期中)NA为阿伏加德罗常数,下列叙述正确的是( ) A.标准状况下,含NA个氩原子的氩气的体积约为11.2 L B.31g白磷分子中,含有的共价单键数目是NA个 C.6 g金刚石晶体中含有的碳碳键数目为2×6.02×1023 D.4.5 g SiO2晶体中含有的硅氧键数目为0.3×6.02×102315.(2分)(2014春•兰州校级期中)下列说法中错误的是( ) A.SO2、SO3都是极性分子 B.在NH4+和[Cu(NH3)4]2+中都存在配位键 C.元素电负性越大的原子,吸引电子的能力越强 D.PCl3和NF3分子中所有原子的最外层都达到8电子稳定结构(4)六方氮化硼在高温高压下,可以转化为立方氮化硼,其结构与金刚石相似,硬度与金刚石相当,晶胞边长为361.5pm,立方氮化硼晶胞中含有 4 个氮原子、 4 个硼原子,立方氮化硼的密度是 x-|||-W Y R-|||-z g•cm﹣3(只要求列算式,不必计算出数值,阿伏伽德罗常数为NA).考点:晶胞的计算;原子核外电子排布;元素电离能、电负性的含义及应用;原子轨道杂化方式及杂化类型判断.版权所有分析:(1)B原子核外有5个电子,根据构造原理书写其基态原子核外电子排布式;同一其元素元素,电负性随着原子序数增大而增大;化合物中各元素化合价的代数和为,该化合物中N元素化合价为﹣3价,据此判断B元素化合价;(2)BF3分子中B原子价层电子对个数是3且不含孤电子对,所以为平面正三角形结构;根据价层电子对互斥理论确定原子杂化方式、微粒空间构型,BF3分子中B原子价层电子对个数是3且不含孤电子对,BF4﹣中B原子价层电子对个数是4且不含孤电子对;(3)不同非金属元素之间易形成极性键;分子之间存在分子间作用力;(4)该晶胞中如果C原子位于顶点和面心上,则N原子位于晶胞内部,且一个顶点和三个面心上C原子连接一个N原子;该晶胞边长=361.5pm=361.5×10﹣10cm,体积=(361.5×10﹣10cm)3,密度=.解答:解:(1)B原子核外有5个电子,根据构造原理书写其基态原子核外电子排布式1s22s22p1;同一其元素元素,电负性随着原子序数增大而增大,所以电负性N>B;化合物中各元素化合价的代数和为,该化合物中N元素化合价为﹣3价,则B元素化合价为+3价,故答案为:1s22s22p1;N;+3;(2)BF3分子中B原子价层电子对个数是3且不含孤电子对,所以为平面正三角形结构,则F﹣B﹣F的键角是120°;根据价层电子对互斥理论确定原子杂化方式、微粒空间构型,BF3分子中B原子价层电子对个数是3且不含孤电子对,BF4﹣中B原子价层电子对个数是4且不含孤电子对,所以BF3分子中B采用sp2杂化、BF4﹣是正四面体结构,故答案为:120°;sp2;正四面体;(3)不同非金属元素之间易形成极性键,所以B﹣N原子之间存在极性键;分子之间存在分子间作用力,所以层之间存在分子间作用力,故答案为:极性键;分子间作用力;(4)该晶胞中如果C原子位于顶点和面心上,则N原子位于晶胞内部,且一个顶点和三个面心上C原子连接一个N原子,所以该晶胞中C原子个数=8×+6×=4、N原子个数为4;该晶胞边长=361.5pm=361.5×10﹣10cm,体积=(361.5×10﹣10cm)3,密度==g•cm﹣3=g•cm﹣3,故答案为:4;4;.点评:本题考查物质结构和性质,涉及晶胞计算、原子杂化方式判断、微粒空间构型判断、原子核外电子排布等知识点,这些都是高频考点,难点是晶胞密度计算,知道密度公式中各个字母含义,题目难度中等.
(13分)(2014春•延边州校级期中)氮化硼(BN)是一种重要的功能陶瓷材料.以天然硼砂为起始物,经过一系列反应可以得到BF3和BN,请回答下列问题
(1)基态B原子的电子排布式为 1s22s22p1 ;B和N相比,电负性较大的是 N ,BN中B元素的化合价为 +3 ;
(2)在BF3分子中,F﹣B﹣F的键角是 120° ,B原子的杂化轨道类型为 sp2 ,BF3和过量NaF作用可生成NaBF4,BF4﹣的立体结构为 正四面体 ;
(3)在与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的化学键为 极性键 ,层间作用力为 分子间作用力 ;
A.
SO2和SiO2
B.
NaCl和HCl
C.
CCl4和KCl
D.
CO2和H2O
10.(1分)(2014春•兰州校级期中)下列说法不正确的是( )
A.
互为同分异构体的分子结构几乎完全相同
B.
丙氨酸CH3﹣CH(NH2)﹣COOH存在手性异构体
C.
标准状况下,相同体积的NH3、CH4、HF含有相同的电子数
D.
等体积的CO和N2混合后所得的混合气体的平均摩尔质量为28 g/mol
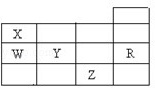
11.(2分)(2012春•泰安期末)右表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( )
A.
常压下五种元素的单质中,Z单质的沸点最高
B.
Y、Z的阴离子电子层结构都与R原子的相同
C.
W的氢化物的沸点比X的氢化物的沸点高
D.
Y元素的非金属性比W元素的非金属性强
12.(2分)(2014春•兰州校级期中)下列各项比较中前者高于(或大于或强于)后者的是( )
A.
CCl4和SiCl4的熔点
B.
邻羟基苯甲醛()和对羟基苯甲醛()的沸点
C.
SO2和CO2在水中的溶解度
D.
H2SO3和H2SO4的酸性
13.(2分)(2015春•新疆校级期中)下列描述中正确的是( )
A.
CS2为V形的极性分子
B.
ClO3﹣的空间构型为平面三角形
C.
SF6中的空间构型为正四面体形
D.
SiF4和SO32﹣的中心原子均为sp3杂化
14.(2分)(2014春•兰州校级期中)NA为阿伏加德罗常数,下列叙述正确的是( )
A.
标准状况下,含NA个氩原子的氩气的体积约为11.2 L
B.
31g白磷分子中,含有的共价单键数目是NA个
C.
6 g金刚石晶体中含有的碳碳键数目为2×6.02×1023
D.
4.5 g SiO2晶体中含有的硅氧键数目为0.3×6.02×1023
15.(2分)(2014春•兰州校级期中)下列说法中错误的是( )
A.
SO2、SO3都是极性分子
B.
在NH4+和[Cu(NH3)4]2+中都存在配位键
C.
元素电负性越大的原子,吸引电子的能力越强
D.
PCl3和NF3分子中所有原子的最外层都达到8电子稳定结构
(4)六方氮化硼在高温高压下,可以转化为立方氮化硼,其结构与金刚石相似,硬度与金刚石相当,晶胞边长为361.5pm,立方氮化硼晶胞中含有 4 个氮原子、 4 个硼原子,立方氮化硼的密度是 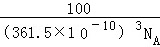 g•cm﹣3(只要求列算式,不必计算出数值,阿伏伽德罗常数为NA).
g•cm﹣3(只要求列算式,不必计算出数值,阿伏伽德罗常数为NA).
考点:
晶胞的计算;原子核外电子排布;元素电离能、电负性的含义及应用;原子轨道杂化方式及杂化类型判断.版权所有
分析:
(1)B原子核外有5个电子,根据构造原理书写其基态原子核外电子排布式;同一其元素元素,电负性随着原子序数增大而增大;化合物中各元素化合价的代数和为,该化合物中N元素化合价为﹣3价,据此判断B元素化合价;
(2)BF3分子中B原子价层电子对个数是3且不含孤电子对,所以为平面正三角形结构;
根据价层电子对互斥理论确定原子杂化方式、微粒空间构型,BF3分子中B原子价层电子对个数是3且不含孤电子对,BF4﹣中B原子价层电子对个数是4且不含孤电子对;
(3)不同非金属元素之间易形成极性键;分子之间存在分子间作用力;
(4)该晶胞中如果C原子位于顶点和面心上,则N原子位于晶胞内部,且一个顶点和三个面心上C原子连接一个N原子;
该晶胞边长=361.5pm=361.5×10﹣10cm,体积=(361.5×10﹣10cm)3,密度=.
解答:
解:(1)B原子核外有5个电子,根据构造原理书写其基态原子核外电子排布式1s22s22p1;
同一其元素元素,电负性随着原子序数增大而增大,所以电负性N>B;
化合物中各元素化合价的代数和为,该化合物中N元素化合价为﹣3价,则B元素化合价为+3价,
故答案为:1s22s22p1;N;+3;
(2)BF3分子中B原子价层电子对个数是3且不含孤电子对,所以为平面正三角形结构,则F﹣B﹣F的键角是120°;
根据价层电子对互斥理论确定原子杂化方式、微粒空间构型,BF3分子中B原子价层电子对个数是3且不含孤电子对,BF4﹣中B原子价层电子对个数是4且不含孤电子对,所以BF3分子中B采用sp2杂化、BF4﹣是正四面体结构,
故答案为:120°;sp2;正四面体;
(3)不同非金属元素之间易形成极性键,所以B﹣N原子之间存在极性键;分子之间存在分子间作用力,所以层之间存在分子间作用力,
故答案为:极性键;分子间作用力;
(4)该晶胞中如果C原子位于顶点和面心上,则N原子位于晶胞内部,且一个顶点和三个面心上C原子连接一个N原子,所以该晶胞中C原子个数=8×+6×=4、N原子个数为4;
该晶胞边长=361.5pm=361.5×10﹣10cm,体积=(361.5×10﹣10cm)3,密度==g•cm﹣3=g•cm﹣3,
故答案为:4;4;.
点评:
本题考查物质结构和性质,涉及晶胞计算、原子杂化方式判断、微粒空间构型判断、原子核外电子排布等知识点,这些都是高频考点,难点是晶胞密度计算,知道密度公式中各个字母含义,题目难度中等.
题目解答
答案
解答:
解:(1)B原子核外有5个电子,根据构造原理书写其基态原子核外电子排布式1s22s22p1;
同一其元素元素,电负性随着原子序数增大而增大,所以电负性N>B;
化合物中各元素化合价的代数和为,该化合物中N元素化合价为﹣3价,则B元素化合价为+3价,
故答案为:1s22s22p1;N;+3;
(2)BF3分子中B原子价层电子对个数是3且不含孤电子对,所以为平面正三角形结构,则F﹣B﹣F的键角是120°;
根据价层电子对互斥理论确定原子杂化方式、微粒空间构型,BF3分子中B原子价层电子对个数是3且不含孤电子对,BF4﹣中B原子价层电子对个数是4且不含孤电子对,所以BF3分子中B采用sp2杂化、BF4﹣是正四面体结构,
故答案为:120°;sp2;正四面体;
(3)不同非金属元素之间易形成极性键,所以B﹣N原子之间存在极性键;分子之间存在分子间作用力,所以层之间存在分子间作用力,
故答案为:极性键;分子间作用力;
(4)该晶胞中如果C原子位于顶点和面心上,则N原子位于晶胞内部,且一个顶点和三个面心上C原子连接一个N原子,所以该晶胞中C原子个数=8×+6×=4、N原子个数为4;
该晶胞边长=361.5pm=361.5×10﹣10cm,体积=(361.5×10﹣10cm)3,密度==g•cm﹣3=g•cm﹣3,
故答案为:4;4;.