题目
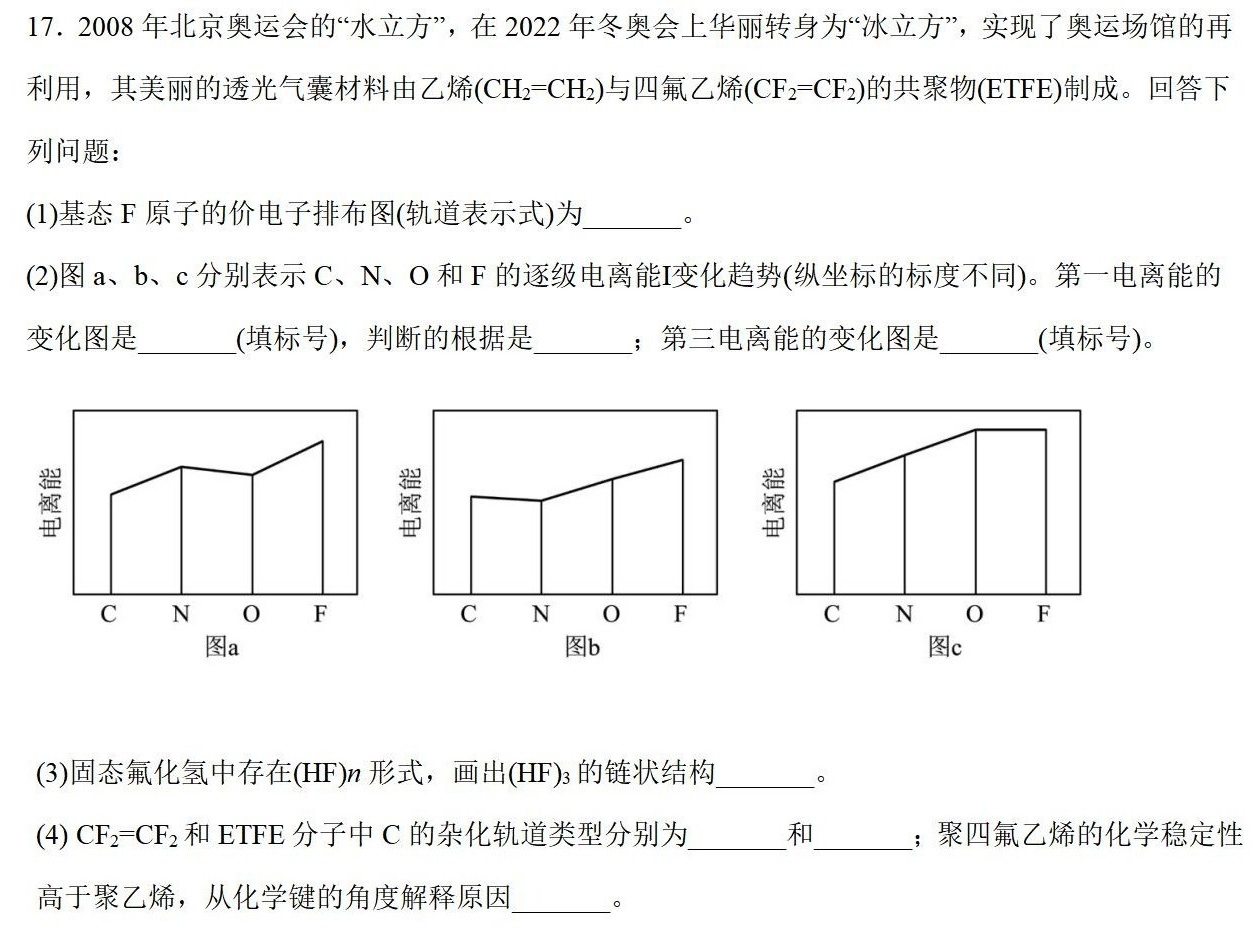
17.2008年北京奥运会的"水立方",在2022年冬奥会上华丽转身为"冰立方",实现了奥运场馆的再-|||-利用,其美丽的透光气囊材料由乙烯 (C)_(2)=C(H)_(2) 与四氟乙烯 ((CF)_(2)=C(F)_(2)) 的共聚物(ETFE)制成。回答下-|||-列问题:-|||-(1)基态F原子的价电子排布图(轨道表示式)为 __ 。-|||-(2)图a、b、c分别表示C、N、O和F的逐级电离能I变化趋势(纵坐标的标度不同)。第一电离能的-|||-变化图是 __ (填标号),判断的根据是 __ 第三电离能的变化图是 __ (填标号)。-|||-恐-|||-C N 0 F C N 0 F C N F-|||-图a 图b 图c-|||-(3)固态氟化氢中存在(HF)n形式,画出(HF)3的链状结构 __ o-|||-(4) (F)_(2)=C(F)_(2) 和ETFE分子中C的杂化轨道类型分别为 __ 和 __ 聚四氟乙烯的化学稳定性-|||-高于聚乙烯,从化学键的角度解释原因 __ 。
题目解答
答案
解析
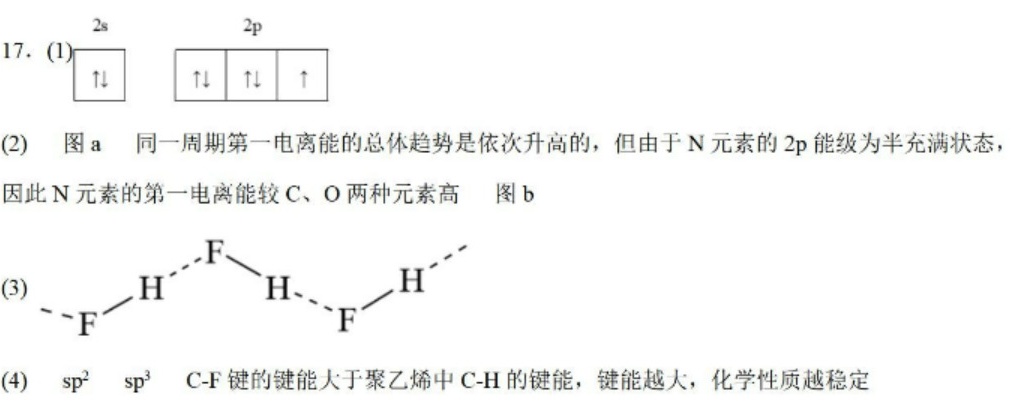
步骤 1:基态F原子的价电子排布图
F原子的电子排布为1s²2s²2p⁵,因此价电子排布图中2s轨道填满,2p轨道有5个电子,其中2p轨道的三个轨道中,一个轨道填满,另外两个轨道各有一个电子。
步骤 2:第一电离能的变化图
第一电离能的变化图是图a,因为同一周期内,第一电离能总体趋势是依次升高的,但由于N元素的2p能级为半充满状态,因此N元素的第一电离能较C、O两种元素高。
步骤 3:第三电离能的变化图
第三电离能的变化图是图b,因为F元素的第三电离能最高,因为F元素的电子结构中,2p轨道已经填满,因此需要更多的能量来移除第三个电子。
步骤 4:固态氟化氢中存在(HF)n形式
固态氟化氢中存在(HF)n形式,其中n=3时,链状结构为H-F-H-F-H-F。
步骤 5:$C{F}_{2}=C{F}_{2}$ 和ETFE分子中C的杂化轨道类型
$C{F}_{2}=C{F}_{2}$ 分子中C的杂化轨道类型为sp²,ETFE分子中C的杂化轨道类型为sp³。
步骤 6:聚四氟乙烯的化学稳定性高于聚乙烯
聚四氟乙烯的化学稳定性高于聚乙烯,因为C-F键的键能大于聚乙烯中C-H的键能,键能越大,化学性质越稳定。
F原子的电子排布为1s²2s²2p⁵,因此价电子排布图中2s轨道填满,2p轨道有5个电子,其中2p轨道的三个轨道中,一个轨道填满,另外两个轨道各有一个电子。
步骤 2:第一电离能的变化图
第一电离能的变化图是图a,因为同一周期内,第一电离能总体趋势是依次升高的,但由于N元素的2p能级为半充满状态,因此N元素的第一电离能较C、O两种元素高。
步骤 3:第三电离能的变化图
第三电离能的变化图是图b,因为F元素的第三电离能最高,因为F元素的电子结构中,2p轨道已经填满,因此需要更多的能量来移除第三个电子。
步骤 4:固态氟化氢中存在(HF)n形式
固态氟化氢中存在(HF)n形式,其中n=3时,链状结构为H-F-H-F-H-F。
步骤 5:$C{F}_{2}=C{F}_{2}$ 和ETFE分子中C的杂化轨道类型
$C{F}_{2}=C{F}_{2}$ 分子中C的杂化轨道类型为sp²,ETFE分子中C的杂化轨道类型为sp³。
步骤 6:聚四氟乙烯的化学稳定性高于聚乙烯
聚四氟乙烯的化学稳定性高于聚乙烯,因为C-F键的键能大于聚乙烯中C-H的键能,键能越大,化学性质越稳定。