绪 论1。1在银催化剂上进行甲醇氧化为甲醛的反应:(H)_(3)OH+(O)_(2)arrow 2HCHO+2(H)_(2)O(H)_(3)OH+(O)_(2)arrow 2HCHO+2(H)_(2)O进入反应器的原料气中,甲醇:空气:水蒸气=2:4:1。3(摩尔比),反应后甲醇的转化率达72%,甲醛的收率为69。2%。试计算(1)(1) 反应的选择性;(2)(2) 反应器出口气体的组成.
绪 论
1。1在银催化剂上进行甲醇氧化为甲醛的反应:
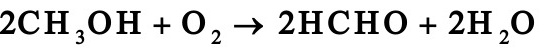
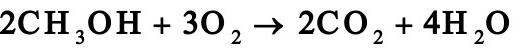
进入反应器的原料气中,甲醇:空气:水蒸气=2:4:1。3(摩尔比),反应后甲醇的转化率达72%,甲醛的收率为69。2%。试计算
(1)(1) 反应的选择性;
(2)(2) 反应器出口气体的组成.
题目解答
答案
解:(1)由(1。7)式得反应的选择性为:
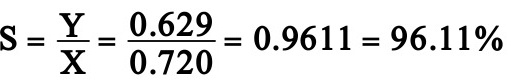
(2)进入反应器的原料气中,甲醇:空气:水蒸气=2:4:1.3(摩尔比),当进入反应器的总原料量为100mol时,则反应器的进料组成为
组分 | 摩尔分率yi0 | 摩尔数ni0(mol) |
CH3OH | 2/(2+4+1。3)=0。2740 | 27。40 |
空气 | 4/(2+4+1。3)=0。5479 | 54。79 |
水 | 1.3/(2+4+1。3)=0.1781 | 17。81 |
总计 | 1。000 | 100。0 |
设甲醇的转化率为XA,甲醛的收率为YP,根据(1。3)和(1。5)式可得反应器出口甲醇、甲醛和二氧化碳的摩尔数nA、nP和nc分别为:
nA=nA0(1-XA)=7.672 mol
nP=nA0YP=18。96 mol
nC=nA0(XA-YP)=0.7672 mol
结合上述反应的化学计量式,水(nW)、氧气(nO)和氮气(nN)的摩尔数分别为:
nW=nW0+nP+2nC=38。30 mol
nO=nO0-1/2nP-3/2nC=0.8788 mol
nN=nN0=43.28 mol
所以,反应器出口气体组成为:
组分 | 摩尔数(mol) | 摩尔分率% |
CH3OH | 7。672 | 6.983 |
HCHO | 18.96 | 17.26 |
H2O | 38。3 | 34.87 |
CO2 | 0。7672 | 0。6983 |
O2 | 0。8788 | 0.7999 |
N2 | 43。28 | 39。39 |
1.1。 2工业上采用铜锌铝催化剂由一氧化碳和氢合成甲醇,其主副反应如下:
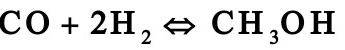
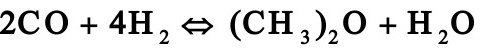
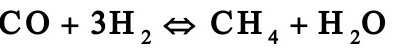
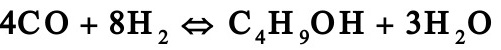

由于化学平衡的限制,反应过程中一氧化碳不可能全部转化成甲醇,为了提高原料的利用率,生产上采用循环操作,即将反应后的气体冷却,可凝组份变为液体即为粗甲醇,不凝组份如氢气及一氧化碳等部分放空,大部分经循环压缩机后与原料气混合返回合成塔中。下图是生产流程示意图
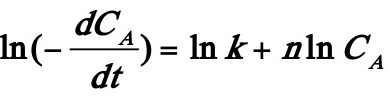
可简化为y=b+ax形式,利用多元回归,可求得反应级数n=1。004≈1,反应速率常数值为k=0。4996。
还可用一数学公式来拟合CA~t曲线,然后再将该数学公式对t求导,求得dCA/dt之值,此法会比作图法来的准确.
2。19在Ni催化剂上进行甲烷化反应:
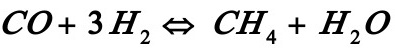
由实验测得200℃时甲烷的生成速率RCH4及CO和H2的分压pCO,pH 2的关系如下:
pCO(MPa) | 0。10 | 0。18 | 0。408 | 0.72 | 1。05 |
pH2(MPa) | 0.1013 | 0。1013 | 0。1013 | 0.1013 | 0。1013 |
RCH4 |
若该反应的动力学方程可用幂函数表示,试用最小二乘法求一氧化碳的反应级数及正反应速率常数。
解:由题意可写出速率方程式:
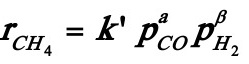
但由于氢的分压保持为0.1013MPa的恒定值,反应速率式可简化为:
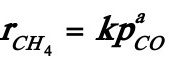
式中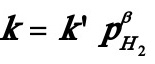 。将速率式直线化:
。将速率式直线化:
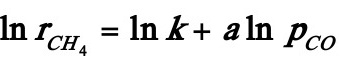 或
或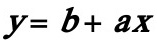
式中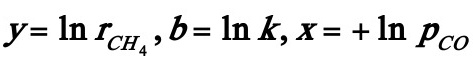 ,由残差平方和最小而导出最小二乘法的系数计算式:
,由残差平方和最小而导出最小二乘法的系数计算式:
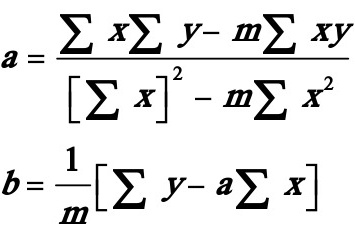
序号 | y | x | x2 | xy |
1 | —4。916 | —2。303 | 5。302 | 11.32 |
2 | -4。328 | —1.715 | 2。941 | 7.421 |
3 | —3.507 | -0.897 | 0.804 | 3.144 |
4 | —2。941 | —0。329 | 0。108 | 0。966 |
5 | —2。564 | —0.049 | 0。002 | —0.125 |
∑ | —18.26 | -5.293 | 9。157 | 22。73 |
将累加值代入a,b系数式中,得:
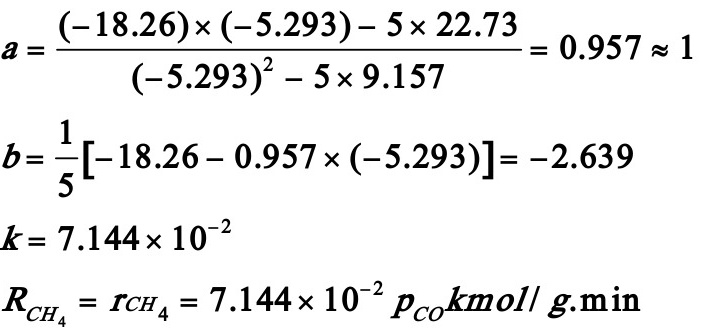
2。20在铂催化剂上,乙烯深度氧化的动力学方程可表示为:
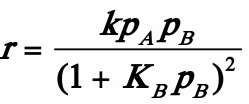
式中pA,pB分别表示乙烯及氧的分压.在473K等温下的实验数据如下:
号 | pA×103MPa | pB×103MPa | r×104mol/g。min |
1 | 8。990 | 3.230 | 0.672 |
2 | 14。22 | 3。000 | 1。072 |
3 | 8。860 | 4.080 | 0.598 |
4 | 8。320 | 2。030 | 0.713 |
5 | 4.370 | 0。890 | 0。610 |
6 | 7。750 | 1。740 | 0。834 |
7 | 7。750 | 1。820 | 0.828 |
8 | 6.170 | 1.730 | 0.656 |
9 | 6。130 | 1.730 | 0.694 |
10 | 6。980 | 1。560 | 0。791 |
11 | 2.870 | 1.060 | 0.418 |
试求该温度下的反应速率常数k和吸附平衡常数KB。
解:首先将动力学方程式直线化:
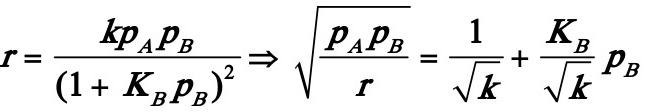
或y=b+ax。其中
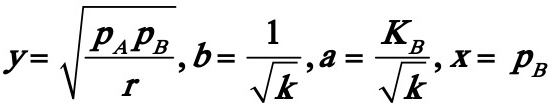
序号 | y | x×103 | x2×105 | xy×103 | r〞×104 | δ,% |
1 | 0。657 | 3。320 | 1.043 | 2。123 | 0.678 | 0.90 |
2 | 0。631 | 3。000 | 0。900 | 1。892 | 1。126 | 5。0 |
3 | 0。778 | 4.080 | 1.665 | 3。172 | 0.568 | 5.0 |
4 | 0.487 | 2.020 | 0.412 | 0。988 | 0。829 | 16。3 |
5 | 0.253 | 0。890 | 0。079 | 0.225 | 0。582 | 4。6 |
6 | 0。402 | 1。740 | 0。303 | 0。700 | 0。833 | 0.1 |
7 | 0.413 | 1。820 | 0。331 | 0。751 | 0。816 | 1。4 |
8 | 0。403 | 1。730 | 0.299 | 0.698 | 0.665 | 1。4 |
9 | 0.391 | 1.730 | 0。299 | 0.676 | 0。661 | 4.8 |
10 | 0。371 | 1.560 | 0.243 | 0。579 | 0。787 | 0.5 |
11 | 0。270 | 1。060 | 0。112 | 0。286 | 0.369 | 11。7 |
∑ | 5.056 | 22。87 | 5。668 | 12。09 |
|
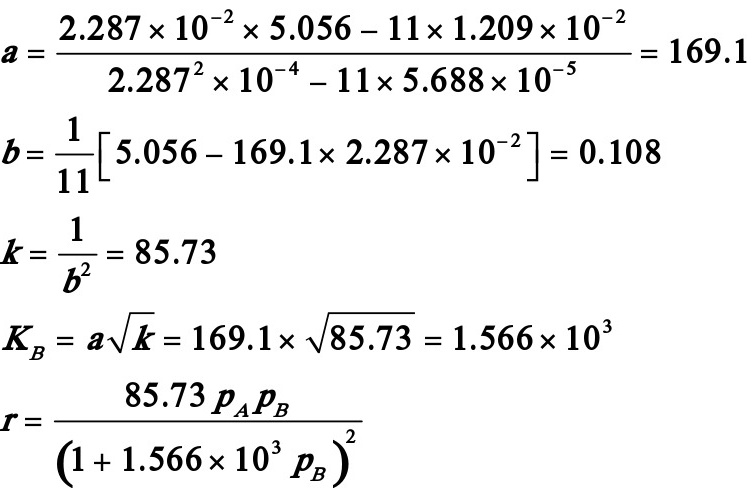
平均偏差 ,结果是令人满意的。
,结果是令人满意的。