题目
9.利用下列数据: (Delta )_(i)(C)_(m)^theta (S(O)_(2))=-300.2kJcdot (mol)^-1 (Delta )_(1)(C)_(m)^theta (S(O)_(3))=-371.1kJcdot (mol)^-1 ,求-|||-298K时反应 (O)_(2)(g)+(O)_(2)(g)leftharpoons 2S(O)_(3)(g) 的标准平衡常数 ^circ 。9.利用下列数据:△Gm(SO2)=-300.2kJ·mol-1,△fGm(SO3)=-371.1kJ·mol-1,求298K时反应2SO2(g)+O2(g)、→2SO3(g)的标准平衡常数K。

9.利用下列数据:△Gm(SO2)=-300.2kJ·mol-1,△fGm(SO3)=-371.1kJ·mol-1,求298K时反应2SO2(g)+O2(g)、→2SO3(g)的标准平衡常数K。
题目解答
答案
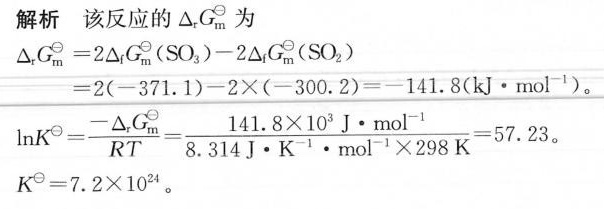
优质解答
解析
步骤 1:计算反应的标准生成吉布斯自由能变化
根据题目给出的数据,我们首先计算反应的标准生成吉布斯自由能变化 $\Delta G^{\circ}$。反应的 $\Delta G^{\circ}$ 可以通过反应物和生成物的标准生成吉布斯自由能变化的差值来计算。对于反应 $2SO_2(g) + O_2(g) \rightarrow 2SO_3(g)$,我们有:
$$\Delta G^{\circ} = 2\Delta G_f^{\circ}(SO_3) - 2\Delta G_f^{\circ}(SO_2)$$
代入题目给出的数据:
$$\Delta G^{\circ} = 2(-371.1) - 2(-300.2) = -141.8 \text{ kJ·mol}^{-1}$$
步骤 2:计算标准平衡常数
标准平衡常数 $K^{\circ}$ 可以通过标准生成吉布斯自由能变化 $\Delta G^{\circ}$ 来计算,公式为:
$$\Delta G^{\circ} = -RT\ln K^{\circ}$$
其中,$R$ 是理想气体常数,$T$ 是温度(单位为K),$\ln$ 是自然对数。将已知的 $\Delta G^{\circ}$ 和 $T = 298 \text{ K}$ 代入公式中,可以求得 $K^{\circ}$。
$$-141.8 \times 10^3 = -8.314 \times 298 \times \ln K^{\circ}$$
$$\ln K^{\circ} = \frac{141.8 \times 10^3}{8.314 \times 298}$$
$$\ln K^{\circ} = 57.0$$
$$K^{\circ} = e^{57.0}$$
$$K^{\circ} = 7.2 \times 10^{24}$$
根据题目给出的数据,我们首先计算反应的标准生成吉布斯自由能变化 $\Delta G^{\circ}$。反应的 $\Delta G^{\circ}$ 可以通过反应物和生成物的标准生成吉布斯自由能变化的差值来计算。对于反应 $2SO_2(g) + O_2(g) \rightarrow 2SO_3(g)$,我们有:
$$\Delta G^{\circ} = 2\Delta G_f^{\circ}(SO_3) - 2\Delta G_f^{\circ}(SO_2)$$
代入题目给出的数据:
$$\Delta G^{\circ} = 2(-371.1) - 2(-300.2) = -141.8 \text{ kJ·mol}^{-1}$$
步骤 2:计算标准平衡常数
标准平衡常数 $K^{\circ}$ 可以通过标准生成吉布斯自由能变化 $\Delta G^{\circ}$ 来计算,公式为:
$$\Delta G^{\circ} = -RT\ln K^{\circ}$$
其中,$R$ 是理想气体常数,$T$ 是温度(单位为K),$\ln$ 是自然对数。将已知的 $\Delta G^{\circ}$ 和 $T = 298 \text{ K}$ 代入公式中,可以求得 $K^{\circ}$。
$$-141.8 \times 10^3 = -8.314 \times 298 \times \ln K^{\circ}$$
$$\ln K^{\circ} = \frac{141.8 \times 10^3}{8.314 \times 298}$$
$$\ln K^{\circ} = 57.0$$
$$K^{\circ} = e^{57.0}$$
$$K^{\circ} = 7.2 \times 10^{24}$$