题目
在一定条件下,将燃煤废气中的CO2转化为二甲醚的反应为:2CO2(g)+6H2(g)⇌CH3OCH3(g)+3H2O(g)△H已知:①CO(g)+2H2(g)⇌CH3OH(g)△H1=-90.7kJ•mol-1②2CH3OH(g)⇌CH3OCH3(g)+H2O(g)△H2=-23.5kJ•mol-1③CO(g)+H2O(g)⇌CO2(g)+H2(g)△H3=-41.2kJ•mol-1(1)△H= ____ kJ•mol-1(2)某温度下,在体积固定为2L的密闭容器中进行反应①,将1mol CO和2mol H2混合,测得不同时刻的反应前后压强关系如表: 时间(min) 5 10 15 20 25 30 压强比(P后/P前) 0.98 0.90 0.80 0.70 0.70 0.70 则达到平衡时CO的转化率为 ____ .(3)已知在某压强下,该反应在不同温度、不同投料比[n(H2)/n(CO2)]时,CO2的转化率如图1所示.从图中可得出三条主要规律:①增大投料比,CO2的转化率增大;② ____ ;③ ____ .C 500K-|||-转化率-|||-60%-|||-600K-|||-40%-|||-- 700K-|||-20% 800K-|||-0 投料比 [ n((H)_(2))Nn(C(O)_(2))] -|||-图1-|||-v(mol·L^(-1)·s^(-1))-|||-v(mol·L^(-1)·g^(n)-|||-a2 v1(CO)-|||-2(CO)-|||-0 t2 t(s)-|||-图3-|||-a,-|||-va(CO)-|||-b-|||-(CO-|||-o m(s-|||-图2(4)反应③的v-t图象如图2所示,若其他条件不变,只是在反应前增大容器体积使压强减小,则其v-t图象如图3所示.下列说法正确的是 ____ ①a1>a2 ②a1<a2 ③b1>b2 ④b1<b2 ⑤t1>t2 ⑥t1=t2 ⑦t1<t2⑧两图中阴影部分面积相等 ⑨右图阴影部分面积更大⑩左图阴影部分面积更大A.①③⑦⑧B.①③⑤⑧C.②④⑦⑨D.①③⑦⑩(5)由甲醇液相脱水法也可制二甲醚,首先将甲醇与浓硫酸反应生成硫酸氢甲酯(CH3OSO3H):CH3OH+H2SO4→CH3OSO3H+H2O;生成的硫酸氢甲酯再和甲醇反应生成二甲醚,第二步的反应方程式为: ____ .与CO2和H2反应制备二甲醚比较,该工艺的优点是反应温度低,转化率高,其缺点是 ____ .
在一定条件下,将燃煤废气中的CO2转化为二甲醚的反应为:
2CO2(g)+6H2(g)⇌CH3OCH3(g)+3H2O(g)△H
已知:①CO(g)+2H2(g)⇌CH3OH(g)△H1=-90.7kJ•mol-1
②2CH3OH(g)⇌CH3OCH3(g)+H2O(g)△H2=-23.5kJ•mol-1
③CO(g)+H2O(g)⇌CO2(g)+H2(g)△H3=-41.2kJ•mol-1
(1)△H= ____ kJ•mol-1
(2)某温度下,在体积固定为2L的密闭容器中进行反应①,将1mol CO和2mol H2混合,测得不同时刻的反应前后压强关系如表:
则达到平衡时CO的转化率为 ____ .
(3)已知在某压强下,该反应在不同温度、不同投料比[n(H2)/n(CO2)]时,CO2的转化率如图1所示.从图中可得出三条主要规律:
①增大投料比,CO2的转化率增大;
② ____ ;
③ ____ .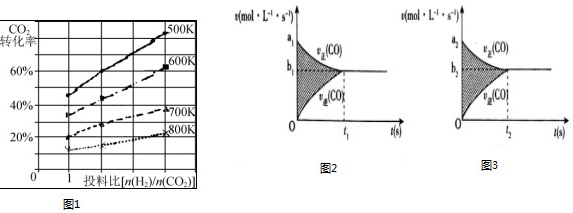
(4)反应③的v-t图象如图2所示,若其他条件不变,只是在反应前增大容器体积使压强减小,则其v-t图象如图3所示.
下列说法正确的是 ____
①a1>a2 ②a1<a2 ③b1>b2 ④b1<b2 ⑤t1>t2 ⑥t1=t2 ⑦t1<t2⑧两图中阴影部分面积相等 ⑨右图阴影部分面积更大⑩左图阴影部分面积更大
A.①③⑦⑧B.①③⑤⑧C.②④⑦⑨D.①③⑦⑩
(5)由甲醇液相脱水法也可制二甲醚,首先将甲醇与浓硫酸反应生成硫酸氢甲酯(CH3OSO3H):CH3OH+H2SO4→CH3OSO3H+H2O;生成的硫酸氢甲酯再和甲醇反应生成二甲醚,第二步的反应方程式为: ____ .与CO2和H2反应制备二甲醚比较,该工艺的优点是反应温度低,转化率高,其缺点是 ____ .
2CO2(g)+6H2(g)⇌CH3OCH3(g)+3H2O(g)△H
已知:①CO(g)+2H2(g)⇌CH3OH(g)△H1=-90.7kJ•mol-1
②2CH3OH(g)⇌CH3OCH3(g)+H2O(g)△H2=-23.5kJ•mol-1
③CO(g)+H2O(g)⇌CO2(g)+H2(g)△H3=-41.2kJ•mol-1
(1)△H= ____ kJ•mol-1
(2)某温度下,在体积固定为2L的密闭容器中进行反应①,将1mol CO和2mol H2混合,测得不同时刻的反应前后压强关系如表:
| 时间(min) | 5 | 10 | 15 | 20 | 25 | 30 |
| 压强比(P后/P前) | 0.98 | 0.90 | 0.80 | 0.70 | 0.70 | 0.70 |
(3)已知在某压强下,该反应在不同温度、不同投料比[n(H2)/n(CO2)]时,CO2的转化率如图1所示.从图中可得出三条主要规律:
①增大投料比,CO2的转化率增大;
② ____ ;
③ ____ .

(4)反应③的v-t图象如图2所示,若其他条件不变,只是在反应前增大容器体积使压强减小,则其v-t图象如图3所示.
下列说法正确的是 ____
①a1>a2 ②a1<a2 ③b1>b2 ④b1<b2 ⑤t1>t2 ⑥t1=t2 ⑦t1<t2⑧两图中阴影部分面积相等 ⑨右图阴影部分面积更大⑩左图阴影部分面积更大
A.①③⑦⑧B.①③⑤⑧C.②④⑦⑨D.①③⑦⑩
(5)由甲醇液相脱水法也可制二甲醚,首先将甲醇与浓硫酸反应生成硫酸氢甲酯(CH3OSO3H):CH3OH+H2SO4→CH3OSO3H+H2O;生成的硫酸氢甲酯再和甲醇反应生成二甲醚,第二步的反应方程式为: ____ .与CO2和H2反应制备二甲醚比较,该工艺的优点是反应温度低,转化率高,其缺点是 ____ .
题目解答
答案
解:(1)①2H2(g)+CO(g)⇌CH3OH(g)△H=-90.7kJ•mol-1
②2CH3OH(g)⇌CH3OCH3(g)+H2O(g)△H=-23.5kJ•mol-1
③CO(g)+H2O(g)⇌CO2(g)+H2(g)△H=-41.2kJ•mol-1
由盖斯定律可知,通过①×2+②+2×③可得所求反应方程式,则△H=2△H1+△H2-2△H3=2×(-90.7kJ•mol-1)-23.5kJ•mol-1+2×41.2kJ•mol-1=-122.5kJ•mol-1,
故答案为:-122.5;
(2)温度、体积不变的可逆反应中,气体的压强之比等于其物质的量之比,15min,压强比(P后/P前)=0.80,则反应后气体的物质的量=3mol×0.80=2.40mol,气体减少的物质的量=3mol-2.4mol=0.6mol,根据气体减少的物质的量与CO之间的关系式知参加反应的CO的物质的量$\frac{0.9mol}{2}$=0.45mol,则CO的转化率=$\frac{0.45mol}{1mol}$×100%=45%,
故答案为:45%;
(3)根据图象可知,[n(H2)/n(CO2)]越大,CO2的转化率越大,温度越高,CO2的转化率小,且图中不同温度线的斜率不同,温度越低,增大投料比使CO2的转化率增大的越显著,
故答案为:升高温度,CO2的转化率降低;温度越低,增大投料比使CO2的转化率增大的越显著;
(4)反应CO(g)+H2O(g)⇌CO2(g)+H2(g)△H=-41.2KJ/mol的v-t图象如图2所示,反应前后气体体积不变,若其他条件不变,只是在反应前增大容器体积使压强减小,物质浓度减小,反应速率减小,达到平衡所需时间变长,阴影部分为反应物浓度变化量,图3中浓度变化比图2中浓度变化小,则分析选项得到:a1>a2,b1>b2,t1<t2,两图中阴影部分面积图3阴影部分面积更小,左图阴影部分面积更大,选择①③⑦⑩,故选D,
故答案为:D;
(5)根据元素守恒可知硫酸氢甲酯再和甲醇反应生成二甲醚的化学方程式为CH3OSO3H+CH3OH→CH3OCH3+H2SO4,该反应有硫酸参加,因为硫酸是强酸,具有较强的腐蚀性,能腐蚀设备,所以根据硫酸的性质可知该工艺的缺点是浓H2SO4腐蚀设备或有硫酸废液产生,
故答案为:CH3OSO3H+CH3OH→CH3OCH3+H2SO4;浓H2SO4腐蚀设备或有硫酸废液产生.
②2CH3OH(g)⇌CH3OCH3(g)+H2O(g)△H=-23.5kJ•mol-1
③CO(g)+H2O(g)⇌CO2(g)+H2(g)△H=-41.2kJ•mol-1
由盖斯定律可知,通过①×2+②+2×③可得所求反应方程式,则△H=2△H1+△H2-2△H3=2×(-90.7kJ•mol-1)-23.5kJ•mol-1+2×41.2kJ•mol-1=-122.5kJ•mol-1,
故答案为:-122.5;
(2)温度、体积不变的可逆反应中,气体的压强之比等于其物质的量之比,15min,压强比(P后/P前)=0.80,则反应后气体的物质的量=3mol×0.80=2.40mol,气体减少的物质的量=3mol-2.4mol=0.6mol,根据气体减少的物质的量与CO之间的关系式知参加反应的CO的物质的量$\frac{0.9mol}{2}$=0.45mol,则CO的转化率=$\frac{0.45mol}{1mol}$×100%=45%,
故答案为:45%;
(3)根据图象可知,[n(H2)/n(CO2)]越大,CO2的转化率越大,温度越高,CO2的转化率小,且图中不同温度线的斜率不同,温度越低,增大投料比使CO2的转化率增大的越显著,
故答案为:升高温度,CO2的转化率降低;温度越低,增大投料比使CO2的转化率增大的越显著;
(4)反应CO(g)+H2O(g)⇌CO2(g)+H2(g)△H=-41.2KJ/mol的v-t图象如图2所示,反应前后气体体积不变,若其他条件不变,只是在反应前增大容器体积使压强减小,物质浓度减小,反应速率减小,达到平衡所需时间变长,阴影部分为反应物浓度变化量,图3中浓度变化比图2中浓度变化小,则分析选项得到:a1>a2,b1>b2,t1<t2,两图中阴影部分面积图3阴影部分面积更小,左图阴影部分面积更大,选择①③⑦⑩,故选D,
故答案为:D;
(5)根据元素守恒可知硫酸氢甲酯再和甲醇反应生成二甲醚的化学方程式为CH3OSO3H+CH3OH→CH3OCH3+H2SO4,该反应有硫酸参加,因为硫酸是强酸,具有较强的腐蚀性,能腐蚀设备,所以根据硫酸的性质可知该工艺的缺点是浓H2SO4腐蚀设备或有硫酸废液产生,
故答案为:CH3OSO3H+CH3OH→CH3OCH3+H2SO4;浓H2SO4腐蚀设备或有硫酸废液产生.