题目
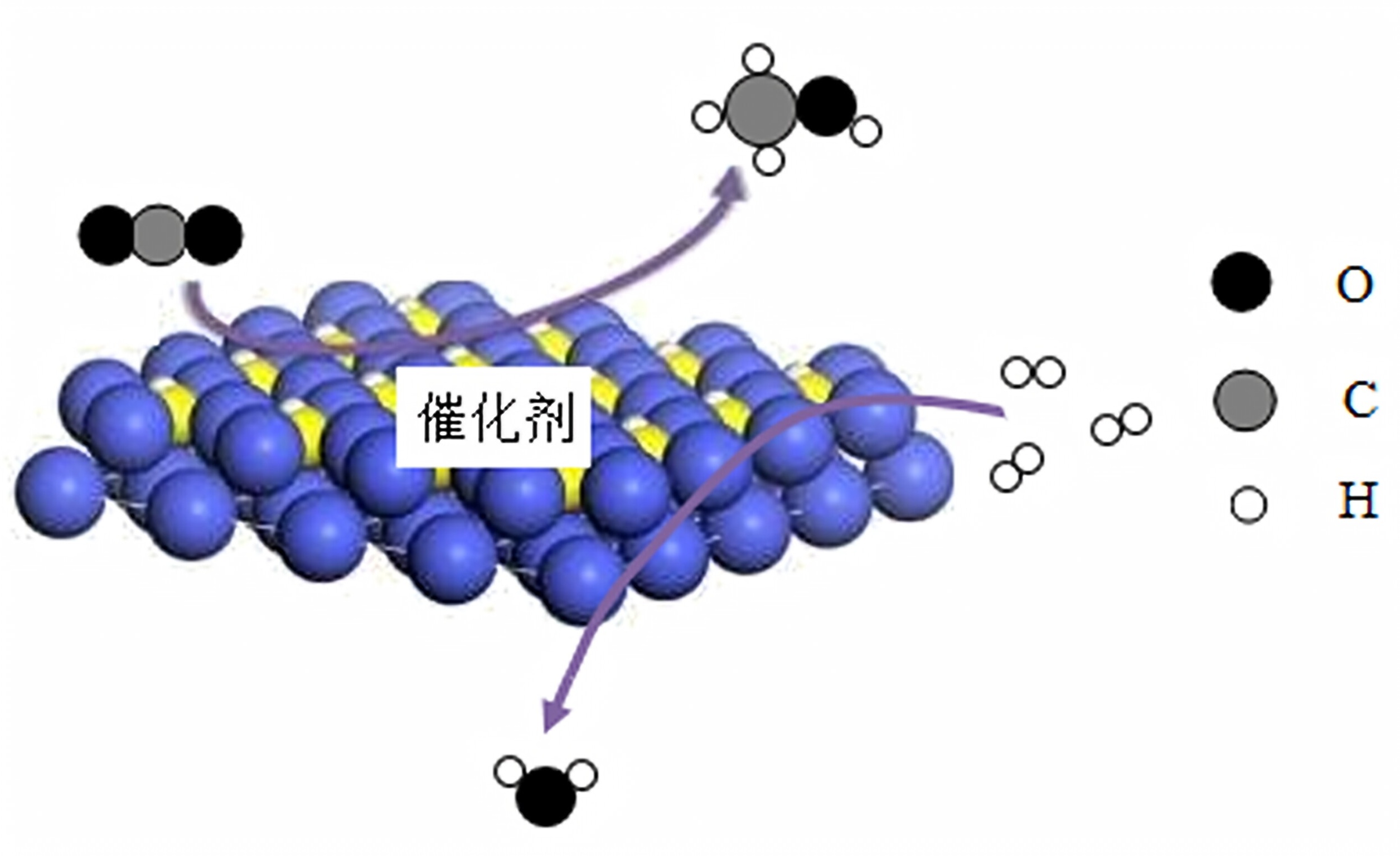
我国力争在2060年前实现“碳中和”(二氧化碳的排放与吸收平衡,实现“零排放”),保护环境。实现“碳中和”通常可采取如下措施:(1)碳减排:使用氢能源汽车可以有效减少二氧化碳的排放。单质硼(B)可与物质X反应制取氢气,化学方程式为:2B+6Xxlongequal[](mathrm{一定条件)}2B(left(OHright))_(3)+3(H)_(2)uparrow ,则X的化学式为 ,依据是 .(2)碳“捕捉”与封存:碳“捕捉”可用氢氧化钠溶液吸收空气中的二氧化碳,生成碳酸钠和水。该反应的化学方程式为 .(3)碳转化:一定条件下,可将二氧化碳在催化剂表面转化成某种有机清洁燃料,其反应原理如下图所示:该反应的化学方程式为 。若反应掉8800g二氧化碳可生成 g有机清洁燃料.Q-|||-O-|||-催化剂 bigcirc C-|||-H-|||-9○○
我国力争在2060年前实现“碳中和”(二氧化碳的排放与吸收平衡,实现“零排放”),保护环境。实现“碳中和”通常可采取如下措施:
(1)碳减排:使用氢能源汽车可以有效减少二氧化碳的排放。单质硼($B$)可与物质X反应制取氢气,化学方程式为:$2B+6Xxlongequal[]{mathrm{一定条件}}2B{left(OHright)}_{3}+3{H}_{2}uparrow $,则X的化学式为 ,依据是 .
(2)碳“捕捉”与封存:碳“捕捉”可用氢氧化钠溶液吸收空气中的二氧化碳,生成碳酸钠和水。该反应的化学方程式为 .
(3)碳转化:一定条件下,可将二氧化碳在催化剂表面转化成某种有机清洁燃料,其反应原理如下图所示:该反应的化学方程式为 。若反应掉8800g二氧化碳可生成 g有机清洁燃料.
题目解答
答案

解析
- 质量守恒定律是解决化学反应式配平和物质化学式推断的核心,需通过反应前后原子数目守恒进行分析。
- 化学方程式书写需注意反应物、生成物的化学式正确性及配平,尤其关注气体、沉淀等标注。
- 化学计量计算需根据化学方程式中物质的摩尔比,结合质量关系进行求解。
第(1)题
确定反应前后原子数目
- 反应前:2个B原子,6个X分子(未知)。
- 反应后:2个B(OH)₃分子含2个B、6个O、6个H;3个H₂分子含6个H。
- 总原子数平衡:B已守恒,O来自X,H来自X和生成物。设X为H₂O,则6个X含12H和6O,与生成物中H、O总数一致。
第(2)题
反应物与生成物分析
- 反应物:CO₂、NaOH。
- 生成物:Na₂CO₃、H₂O。
- 配平:CO₂与NaOH的系数比为1:2,生成1mol Na₂CO₃和1mol H₂O。
第(3)题
反应式推导
- 反应物:CO₂和H₂。
- 生成物:CH₃OH(甲醇)和H₂O。
- 配平:CO₂ + 3H₂ → CH₃OH + H₂O(各物质系数均为1)。
质量计算
- 化学计量比:CO₂与CH₃OH的摩尔比为1:1。
- 计算步骤:
- 计算CO₂的物质的量:$\frac{8800\ \text{g}}{44\ \text{g/mol}} = 200\ \text{mol}$。
- 生成CH₃OH的物质的量为200 mol。
- CH₃OH的质量:$200\ \text{mol} \times 32\ \text{g/mol} = 6400\ \text{g}$。