题目
公元前9世纪,二氧化硫就被用于消毒和漂白。实验室可用下列装置(部分夹持仪器略去)制取SO2并验证其性质。70%H2SO4溶液-|||-Na2SO3-|||-K-|||-。-|||-K2S溶-|||-液-|||-A B c D E(1)检查装置A、B气密性的操作为:先关闭装置A中分液漏斗活塞和装置B中止水夹K,往长颈漏斗中注水至水柱高于广口瓶液面,若观察到 ____ ,则气密性良好。(2)装置A中反应的化学方程式为 ____ 。(3)实验时,通气一段时间后,C中试管中出现大量淡黄色浑浊现象,证明二氧化硫具有 ____ (填“还原性”、“氧化性”或“漂白性”)。经测定,产物中含一种摩尔质量为120g•mol-1的盐,该盐的化学式为 ____ 。(4)实验结束时,关闭止水夹K,装置B所起的作用是 ____ 。(5)取少量试管D中的溶液,加入BaCl2溶液,产生白色沉淀。①该白色沉淀为 ____ (写化学式)。②原试管D中反应的化学方程式为 ____ 。(6)用如图装置验证H2SO3酸性比H2CO3强。70%H2SO4溶液-|||-Na2SO3-|||-K-|||-。-|||-K2S溶-|||-液-|||-A B c D E请从下列试剂中选择合适试剂以完成实验(要求:试剂不重复,填代号):a.品红溶液 b.酸性KMnO4溶液 c.饱和NaHCO3溶液 d.饱和NaHSO3溶液X为 ____ ,Y为 ____ ,Z为 ____ 。
公元前9世纪,二氧化硫就被用于消毒和漂白。实验室可用下列装置(部分夹持仪器略去)制取SO2并验证其性质。
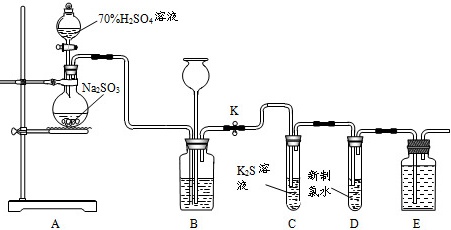
(1)检查装置A、B气密性的操作为:先关闭装置A中分液漏斗活塞和装置B中止水夹K,往长颈漏斗中注水至水柱高于广口瓶液面,若观察到 ____ ,则气密性良好。
(2)装置A中反应的化学方程式为 ____ 。
(3)实验时,通气一段时间后,C中试管中出现大量淡黄色浑浊现象,证明二氧化硫具有 ____ (填“还原性”、“氧化性”或“漂白性”)。经测定,产物中含一种摩尔质量为120g•mol-1的盐,该盐的化学式为 ____ 。
(4)实验结束时,关闭止水夹K,装置B所起的作用是 ____ 。
(5)取少量试管D中的溶液,加入BaCl2溶液,产生白色沉淀。
①该白色沉淀为 ____ (写化学式)。
②原试管D中反应的化学方程式为 ____ 。
(6)用如图装置验证H2SO3酸性比H2CO3强。
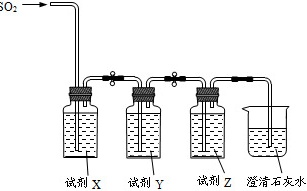
请从下列试剂中选择合适试剂以完成实验(要求:试剂不重复,填代号):
a.品红溶液 b.酸性KMnO4溶液 c.饱和NaHCO3溶液 d.饱和NaHSO3溶液
X为 ____ ,Y为 ____ ,Z为 ____ 。

(1)检查装置A、B气密性的操作为:先关闭装置A中分液漏斗活塞和装置B中止水夹K,往长颈漏斗中注水至水柱高于广口瓶液面,若观察到 ____ ,则气密性良好。
(2)装置A中反应的化学方程式为 ____ 。
(3)实验时,通气一段时间后,C中试管中出现大量淡黄色浑浊现象,证明二氧化硫具有 ____ (填“还原性”、“氧化性”或“漂白性”)。经测定,产物中含一种摩尔质量为120g•mol-1的盐,该盐的化学式为 ____ 。
(4)实验结束时,关闭止水夹K,装置B所起的作用是 ____ 。
(5)取少量试管D中的溶液,加入BaCl2溶液,产生白色沉淀。
①该白色沉淀为 ____ (写化学式)。
②原试管D中反应的化学方程式为 ____ 。
(6)用如图装置验证H2SO3酸性比H2CO3强。

请从下列试剂中选择合适试剂以完成实验(要求:试剂不重复,填代号):
a.品红溶液 b.酸性KMnO4溶液 c.饱和NaHCO3溶液 d.饱和NaHSO3溶液
X为 ____ ,Y为 ____ ,Z为 ____ 。
题目解答
答案
解:(1)检查装置A、B气密性的操作为:先关闭装置A中分液漏斗活塞和装置B中止水夹K,往长颈漏斗中注水至水柱高于广口瓶液面,若观察到:水柱高度保持不变,则气密性良好,
故答案为:水柱高度保持不变;
(2)装置A中反应是浓硫酸和亚硫酸钠反应生成二氧化硫、硫酸钠和水,反应的化学方程式为:Na2SO3+H2SO4═Na2SO4+H2O+SO2↑,
故答案为:Na2SO3+H2SO4═Na2SO4+H2O+SO2↑;
(3)实验时,通气一段时间后,C中试管中出现大量淡黄色浑浊现象,二氧化硫和硫化钠反应生成了硫单质,经测定,产物中含有一种摩尔质量为104g•mol-1的盐,是二氧化硫和氢氧化钠溶液反应生成的亚硫酸氢钠,化学式为:NaHSO3,C中发生反应的化学方程式为:5SO2+2Na2S+2H2O=3S↓+4NaHSO3,反应中二氧化硫中硫元素化合价降低,证明了二氧化硫具有氧化性,
故答案为:氧化性;NaHSO3;
(4)实验结束时,关闭止水夹K,装置B所起的作用是:储气瓶或安全瓶,
故答案为:储气瓶或安全瓶;
(5)①二氧化硫通入D装置的氯水中发生反应为:SO2+Cl2+H2O=4H++2Cl-+${SO}_{4}^{2-}$,取少量试管D中的溶液,加入BaCl2溶液,产生白色沉淀为:BaSO4,
故答案为:BaSO4;
②原试管D中反应的化学方程式为:SO2+Cl2+2H2O═H2SO4+2HCl,
故答案为:SO2+Cl2+2H2O═H2SO4+2HCl;
(6)验证H2SO3比H2CO3酸性强,可以用亚硫酸与碳酸盐或碳酸氢盐反应生成二氧化碳即可,所以将二氧化硫通入碳酸氢钠溶液中,用高锰酸钾溶液除去混合气体中的二氧化硫,用品红溶液检验二氧化硫是否除尽,除去二氧化硫后如果澄清石灰水变浑,则说明有二氧化碳产生,即可证明H2SO3比H2CO3酸性强,X为c.饱和NaHCO3溶液,Y为b.酸性KMnO4溶液,Z为a.品红溶液,
故答案为:c;b;a。
故答案为:水柱高度保持不变;
(2)装置A中反应是浓硫酸和亚硫酸钠反应生成二氧化硫、硫酸钠和水,反应的化学方程式为:Na2SO3+H2SO4═Na2SO4+H2O+SO2↑,
故答案为:Na2SO3+H2SO4═Na2SO4+H2O+SO2↑;
(3)实验时,通气一段时间后,C中试管中出现大量淡黄色浑浊现象,二氧化硫和硫化钠反应生成了硫单质,经测定,产物中含有一种摩尔质量为104g•mol-1的盐,是二氧化硫和氢氧化钠溶液反应生成的亚硫酸氢钠,化学式为:NaHSO3,C中发生反应的化学方程式为:5SO2+2Na2S+2H2O=3S↓+4NaHSO3,反应中二氧化硫中硫元素化合价降低,证明了二氧化硫具有氧化性,
故答案为:氧化性;NaHSO3;
(4)实验结束时,关闭止水夹K,装置B所起的作用是:储气瓶或安全瓶,
故答案为:储气瓶或安全瓶;
(5)①二氧化硫通入D装置的氯水中发生反应为:SO2+Cl2+H2O=4H++2Cl-+${SO}_{4}^{2-}$,取少量试管D中的溶液,加入BaCl2溶液,产生白色沉淀为:BaSO4,
故答案为:BaSO4;
②原试管D中反应的化学方程式为:SO2+Cl2+2H2O═H2SO4+2HCl,
故答案为:SO2+Cl2+2H2O═H2SO4+2HCl;
(6)验证H2SO3比H2CO3酸性强,可以用亚硫酸与碳酸盐或碳酸氢盐反应生成二氧化碳即可,所以将二氧化硫通入碳酸氢钠溶液中,用高锰酸钾溶液除去混合气体中的二氧化硫,用品红溶液检验二氧化硫是否除尽,除去二氧化硫后如果澄清石灰水变浑,则说明有二氧化碳产生,即可证明H2SO3比H2CO3酸性强,X为c.饱和NaHCO3溶液,Y为b.酸性KMnO4溶液,Z为a.品红溶液,
故答案为:c;b;a。