题目
碘酸钾(KIO3)为白色固体,可溶于水,常作为补碘剂被添加到食盐中。小组同学实验探究其性质如下:【实验1】探究KIO3的热稳定性。按如图装置完成实验: 序号 1﹣1 1﹣2 装置 KIO3固体 KIO3固体 现象 加热较长时间后,导管口持续产生气泡 a 【结论与反思】(1)食盐中加碘可预防 ____ 疾病。(2)实验1-2中a处现象为 ____ ,说明1-1中收集到的气体是氧气。由此证明碘酸钾与氯酸钾一样受热会分解且反应相似,请写出碘酸钾受热分解的文字或符号表达式 ____ 。【实验2】探究KIO3与维生素C的反应及其影响因素。取不同浓度的碘酸钾和维生素C溶液按下表进行实验:【查阅资料】a.淀粉溶液遇单质碘(I2)变为蓝色,遇KIO3、维生素C、醋酸均不变色。 装置 序号 溶液的浓度 实验现象 碘酸钾 维生素C KIO3固体 2-1 10% 10% 溶液立即由无色变为蓝色 2-2 0.5% 0.5% 溶液慢慢由无色变为蓝色 2-3 0.25% 0.25% 一段时间后溶液无明显变化,再滴入5滴稀醋酸后,溶液逐渐变为浅蓝色 (3)根据实验中“KIO3溶液与维生素C溶液均不能使淀粉变蓝色,但是两者混合后淀粉变蓝色”这一实验现象可得出的结论是 ____ 。(4)对比实验2﹣1、2﹣2,可探究的影响KIO3与维生素C反应的因素是 ____ 。(5)由实验2﹣3现象得出:醋酸会 ____ (选填“促进”或“抑制”)KIO3与维生素C的反应。(6)影响反应速度因素有很多,比如催化剂的种类。小明通过查阅资料发现氧化铜也能作过氧化氢分解的催化剂,为比较氧化铜和二氧化锰对过氧化氢分解的催化效果,小明用图乙所示装置做对照实验,以生成30mL气体为标准(其他可能影响实验的因素均已忽略)设计了下列三组实验。KIO3固体 实验序号 5%过氧化氢溶液体积/mL 其他物质质量 待测数据 3-1 20 / a 3-2 20 氧化铜0.5g b 3-3 20 二氧化锰0.5g c ①做实验3﹣1的目的是 ____ 。②若待测数据b ____ c(填“>”、“=”或“<”)可知二氧化锰对过氧化氢分解的催化效果更好。【反思】(7)影响化学反应速率的因素除了催化剂的种类、反应物浓度外,还可能与 ____ 有关。
碘酸钾(KIO3)为白色固体,可溶于水,常作为补碘剂被添加到食盐中。小组同学实验探究其性质如下:
【实验1】探究KIO3的热稳定性。按如图装置完成实验:
【结论与反思】
(1)食盐中加碘可预防 ____ 疾病。
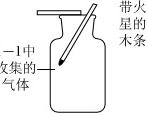
(2)实验1-2中a处现象为 ____ ,说明1-1中收集到的气体是氧气。由此证明碘酸钾与氯酸钾一样受热会分解且反应相似,请写出碘酸钾受热分解的文字或符号表达式 ____ 。
【实验2】探究KIO3与维生素C的反应及其影响因素。取不同浓度的碘酸钾和维生素C溶液按下表进行实验:
【查阅资料】
a.淀粉溶液遇单质碘(I2)变为蓝色,遇KIO3、维生素C、醋酸均不变色。
(3)根据实验中“KIO3溶液与维生素C溶液均不能使淀粉变蓝色,但是两者混合后淀粉变蓝色”这一实验现象可得出的结论是 ____ 。
(4)对比实验2﹣1、2﹣2,可探究的影响KIO3与维生素C反应的因素是 ____ 。
(5)由实验2﹣3现象得出:醋酸会 ____ (选填“促进”或“抑制”)KIO3与维生素C的反应。
(6)影响反应速度因素有很多,比如催化剂的种类。小明通过查阅资料发现氧化铜也能作过氧化氢分解的催化剂,为比较氧化铜和二氧化锰对过氧化氢分解的催化效果,小明用图乙所示装置做对照实验,以生成30mL气体为标准(其他可能影响实验的因素均已忽略)设计了下列三组实验。
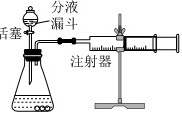
①做实验3﹣1的目的是 ____ 。
②若待测数据b ____ c(填“>”、“=”或“<”)可知二氧化锰对过氧化氢分解的催化效果更好。
【反思】
(7)影响化学反应速率的因素除了催化剂的种类、反应物浓度外,还可能与 ____ 有关。
【实验1】探究KIO3的热稳定性。按如图装置完成实验:
| 序号 | 1﹣1 | 1﹣2 |
| 装置 | 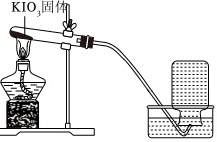 |
 |
| 现象 | 加热较长时间后,导管口持续产生气泡 | a |
(1)食盐中加碘可预防 ____ 疾病。
(2)实验1-2中a处现象为 ____ ,说明1-1中收集到的气体是氧气。由此证明碘酸钾与氯酸钾一样受热会分解且反应相似,请写出碘酸钾受热分解的文字或符号表达式 ____ 。
【实验2】探究KIO3与维生素C的反应及其影响因素。取不同浓度的碘酸钾和维生素C溶液按下表进行实验:
【查阅资料】
a.淀粉溶液遇单质碘(I2)变为蓝色,遇KIO3、维生素C、醋酸均不变色。
| 装置 | 序号 | 溶液的浓度 | 实验现象 | |
| 碘酸钾 | 维生素C | |||
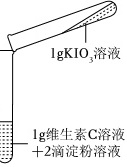 |
2-1 | 10% | 10% | 溶液立即由无色变为蓝色 |
| 2-2 | 0.5% | 0.5% | 溶液慢慢由无色变为蓝色 | |
| 2-3 | 0.25% | 0.25% | 一段时间后溶液无明显变化,再滴入5滴稀醋酸后,溶液逐渐变为浅蓝色 | |
(4)对比实验2﹣1、2﹣2,可探究的影响KIO3与维生素C反应的因素是 ____ 。
(5)由实验2﹣3现象得出:醋酸会 ____ (选填“促进”或“抑制”)KIO3与维生素C的反应。
(6)影响反应速度因素有很多,比如催化剂的种类。小明通过查阅资料发现氧化铜也能作过氧化氢分解的催化剂,为比较氧化铜和二氧化锰对过氧化氢分解的催化效果,小明用图乙所示装置做对照实验,以生成30mL气体为标准(其他可能影响实验的因素均已忽略)设计了下列三组实验。

| 实验序号 | 5%过氧化氢溶液体积/mL | 其他物质质量 | 待测数据 |
| 3-1 | 20 | / | a |
| 3-2 | 20 | 氧化铜0.5g | b |
| 3-3 | 20 | 二氧化锰0.5g | c |
②若待测数据b ____ c(填“>”、“=”或“<”)可知二氧化锰对过氧化氢分解的催化效果更好。
【反思】
(7)影响化学反应速率的因素除了催化剂的种类、反应物浓度外,还可能与 ____ 有关。
题目解答
答案
解:(1)食盐中加碘,可以补充碘元素,预防甲状腺疾病;
(2)1-1中收集到的气体是氧气,氧气具有助燃性,能使带火星的木条复燃,则a处现象为带火星的木条复燃,碘酸钾与氯酸钾一样受热会分解且反应相似,氯酸钾受热分解生成氯化钾和氧气,则碘酸钾受热分解生成碘化钾和氧气,故反应的文字或符号表达式为碘酸钾$\stackrel{加热}{→}$碘化钾+氧气或KIO3$\stackrel{△}{→}$KI+O2;
(3)淀粉溶液遇单质碘(I2)变为蓝色,而“KIO3 溶液与维生素C溶液均不能使淀粉变蓝色,但是两者混合后淀粉变蓝色”这一实验现象可得出的结论是KIO3能与维生素C反应生成I2;
(4)对比实验2-1、2-2,变量是溶液的浓度,且溶液浓度越大,反应速率越快,故可探究的影响KIO3与维生素C反应的因素是溶液的浓度;
(5)由实验2-3可知,一段时间后溶液无明显变化,再滴入5滴稀醋酸后,溶液逐渐变为浅蓝色,说明醋酸会促进KIO3与维生素C的反应;
(6)①实验3-1中未加催化剂,故目的是与实验3-2和实验3-3作对比;
②二氧化锰对过氧化氢分解的催化效果更好,故相同条件下,使用二氧化锰作催化剂时,收集等体积气体所需时间短,即b>c;
(7)影响化学反应速率的因素除了催化剂的种类、反应物浓度外,还可能与温度有关。
故答案为:(1)甲状腺;
(2)带火星的木条复燃;碘酸钾$\stackrel{加热}{→}$碘化钾+氧气或KIO3$\stackrel{△}{→}$KI+O2;
(3)KIO3能与维生素C反应生成I2;
(4)溶液的浓度;
(5)促进;
(6)与实验3-2和实验3-3作对比;>;
(7)温度。
(2)1-1中收集到的气体是氧气,氧气具有助燃性,能使带火星的木条复燃,则a处现象为带火星的木条复燃,碘酸钾与氯酸钾一样受热会分解且反应相似,氯酸钾受热分解生成氯化钾和氧气,则碘酸钾受热分解生成碘化钾和氧气,故反应的文字或符号表达式为碘酸钾$\stackrel{加热}{→}$碘化钾+氧气或KIO3$\stackrel{△}{→}$KI+O2;
(3)淀粉溶液遇单质碘(I2)变为蓝色,而“KIO3 溶液与维生素C溶液均不能使淀粉变蓝色,但是两者混合后淀粉变蓝色”这一实验现象可得出的结论是KIO3能与维生素C反应生成I2;
(4)对比实验2-1、2-2,变量是溶液的浓度,且溶液浓度越大,反应速率越快,故可探究的影响KIO3与维生素C反应的因素是溶液的浓度;
(5)由实验2-3可知,一段时间后溶液无明显变化,再滴入5滴稀醋酸后,溶液逐渐变为浅蓝色,说明醋酸会促进KIO3与维生素C的反应;
(6)①实验3-1中未加催化剂,故目的是与实验3-2和实验3-3作对比;
②二氧化锰对过氧化氢分解的催化效果更好,故相同条件下,使用二氧化锰作催化剂时,收集等体积气体所需时间短,即b>c;
(7)影响化学反应速率的因素除了催化剂的种类、反应物浓度外,还可能与温度有关。
故答案为:(1)甲状腺;
(2)带火星的木条复燃;碘酸钾$\stackrel{加热}{→}$碘化钾+氧气或KIO3$\stackrel{△}{→}$KI+O2;
(3)KIO3能与维生素C反应生成I2;
(4)溶液的浓度;
(5)促进;
(6)与实验3-2和实验3-3作对比;>;
(7)温度。