题目
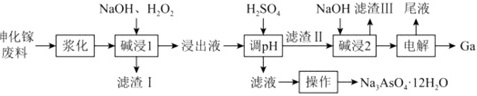
从砷化镓废料(主要成分为GaAs、含Fe2O3、SiO2和CaCO3等杂质)中回收镓和砷的工艺流程如图所示:NaOH、H2O2 H2SO4 NaOH滤渣Ⅲ 尾液-|||-申化镓 ↓ ↑-|||-废料 一 浆化 → 碱浸1 → 浸出液 调pH 滤渣Ⅱ 碱浸2 → 电解 Ga-|||-↓-|||-滤渣I 滤液→ 操作 →Na3AsO4·12H2O已知:①Ga与Al同族,Ga(OH)3是两性氢氧化物。②25℃时,Ksp[Ga(OH)3]=7.0×10-36,电离常数Ka[Ga(OH)3]=1.0×10-7。回答下列问题:(1)写出Ga(OH)3在水中的电离方程式: ____ 。(2)“浆化”过程将砷化镓废料转变为悬浊液,目的是 ____ 。(3)“碱浸1”过程,砷化镓转化为NaGaO2和Na3AsO4,该反应的离子方程式为 ____ 。(4)为提高镓的回收率,加硫酸调pH的最大值是 ____ (溶液中含镓元素的微粒的浓度不大于1.0×10-6时,认为该微粒沉淀完全,lg7≈0.85)。(5)“电解”是指用传统的方法将Ga(OH)3溶解到NaOH溶液中,电解得到金属镍。电解时,GaO2-在阴极放电的电极反应式: ____ 。(6)向“调pH”后得到的滤液中加入足量NaOH溶液,使pH大于12,经 ____ 、降温结晶、过滤、洗涤、 ____ 后得到Na3AsO4⋅12H2O。(7)某同学为了探究可逆反应AsO33-(aq)+I2(aq)+2OH-(aq)⇌AsO43-(aq)+2I-(aq)+H2O(l)。设计如图1所示装置。实验操作及现象:按图1装置加入试剂并连接装置,电流由C2流向C1。当不产生电流时,向图1装置左边烧杯中加入一定量2mol⋅L-1盐酸,发现又产生电流,实验中电流与时间的关系如图2所示:NaOH、H2O2 H2SO4 NaOH滤渣Ⅲ 尾液-|||-申化镓 ↓ ↑-|||-废料 一 浆化 → 碱浸1 → 浸出液 调pH 滤渣Ⅱ 碱浸2 → 电解 Ga-|||-↓-|||-滤渣I 滤液→ 操作 →Na3AsO4·12H2O下列说法正确的是 ____ 。a.实验开始时,电子由C1经盐桥流向C2b.图2中,b点时反应达到化学平衡状态c.向左边烧杯中加入盐酸后,平衡逆向移动d.若将所加的盐酸换成氢氧化钠溶液,平衡逆向移动,电流增大
从砷化镓废料(主要成分为GaAs、含Fe2O3、SiO2和CaCO3等杂质)中回收镓和砷的工艺流程如图所示:
已知:①Ga与Al同族,Ga(OH)3是两性氢氧化物。
②25℃时,Ksp[Ga(OH)3]=7.0×10-36,电离常数Ka[Ga(OH)3]=1.0×10-7。
回答下列问题:
(1)写出Ga(OH)3在水中的电离方程式: ____ 。
(2)“浆化”过程将砷化镓废料转变为悬浊液,目的是 ____ 。
(3)“碱浸1”过程,砷化镓转化为NaGaO2和Na3AsO4,该反应的离子方程式为 ____ 。
(4)为提高镓的回收率,加硫酸调pH的最大值是 ____ (溶液中含镓元素的微粒的浓度不大于1.0×10-6时,认为该微粒沉淀完全,lg7≈0.85)。
(5)“电解”是指用传统的方法将Ga(OH)3溶解到NaOH溶液中,电解得到金属镍。电解时,GaO2-在阴极放电的电极反应式: ____ 。
(6)向“调pH”后得到的滤液中加入足量NaOH溶液,使pH大于12,经 ____ 、降温结晶、过滤、洗涤、 ____ 后得到Na3AsO4⋅12H2O。
(7)某同学为了探究可逆反应AsO33-(aq)+I2(aq)+2OH-(aq)⇌AsO43-(aq)+2I-(aq)+H2O(l)。设计如图1所示装置。实验操作及现象:按图1装置加入试剂并连接装置,电流由C2流向C1。当不产生电流时,向图1装置左边烧杯中加入一定量2mol⋅L-1盐酸,发现又产生电流,实验中电流与时间的关系如图2所示:
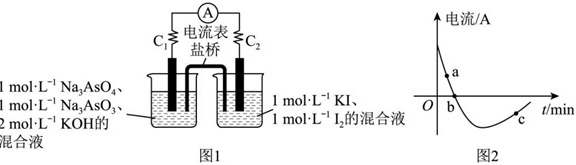
下列说法正确的是 ____ 。
a.实验开始时,电子由C1经盐桥流向C2
b.图2中,b点时反应达到化学平衡状态
c.向左边烧杯中加入盐酸后,平衡逆向移动
d.若将所加的盐酸换成氢氧化钠溶液,平衡逆向移动,电流增大

已知:①Ga与Al同族,Ga(OH)3是两性氢氧化物。
②25℃时,Ksp[Ga(OH)3]=7.0×10-36,电离常数Ka[Ga(OH)3]=1.0×10-7。
回答下列问题:
(1)写出Ga(OH)3在水中的电离方程式: ____ 。
(2)“浆化”过程将砷化镓废料转变为悬浊液,目的是 ____ 。
(3)“碱浸1”过程,砷化镓转化为NaGaO2和Na3AsO4,该反应的离子方程式为 ____ 。
(4)为提高镓的回收率,加硫酸调pH的最大值是 ____ (溶液中含镓元素的微粒的浓度不大于1.0×10-6时,认为该微粒沉淀完全,lg7≈0.85)。
(5)“电解”是指用传统的方法将Ga(OH)3溶解到NaOH溶液中,电解得到金属镍。电解时,GaO2-在阴极放电的电极反应式: ____ 。
(6)向“调pH”后得到的滤液中加入足量NaOH溶液,使pH大于12,经 ____ 、降温结晶、过滤、洗涤、 ____ 后得到Na3AsO4⋅12H2O。
(7)某同学为了探究可逆反应AsO33-(aq)+I2(aq)+2OH-(aq)⇌AsO43-(aq)+2I-(aq)+H2O(l)。设计如图1所示装置。实验操作及现象:按图1装置加入试剂并连接装置,电流由C2流向C1。当不产生电流时,向图1装置左边烧杯中加入一定量2mol⋅L-1盐酸,发现又产生电流,实验中电流与时间的关系如图2所示:

下列说法正确的是 ____ 。
a.实验开始时,电子由C1经盐桥流向C2
b.图2中,b点时反应达到化学平衡状态
c.向左边烧杯中加入盐酸后,平衡逆向移动
d.若将所加的盐酸换成氢氧化钠溶液,平衡逆向移动,电流增大
题目解答
答案
解:(1)Ga(OH)3是两性氢氧化物,类比氢氧化铝,其电离方程式为:Ga3++3OH-⇌Ga(OH)3⇌H2O+H++GaO2-,
故答案为:Ga3++3OH-⇌Ga(OH)3⇌H2O+H++GaO2-;
(2)“浆化”过程将砷化镓废料转变为悬浊液,目的是:增大固液接触面积,提高碱浸速率,
故答案为:增大固液接触面积,提高碱浸速率;
(3)“碱浸1”过程加入了NaOH是碱性环境,加入的H2O2体现氧化性,砷化镓转化为NaGaO2和Na3AsO4,所以该反应的离子方程式:GaAs+4OH-+4H2O2=GaO2-+AsO43-+6H2O,
故答案为:GaAs+4OH-+4H2O2=GaO2-+AsO43-+6H2O;
(4)根据要求溶液中含镓元素的微粒的浓度不大于1.0×10-6时,认为该微粒沉淀完全,则溶液的pH大于GaO2-完全沉淀的pH,小于Ga(OH)3开始溶解的pH,Ksp[Ga(OH)3]=7.0×10-36,则c(OH-)=$\root{3}{\frac{{K}_{sp}[Ga(OH)_{3}]}{1{0}^{-6}}}$=$\root{3}{\frac{7.0×1{0}^{-36}}{1{0}^{-6}}}$=$\root{3}{7}$×10-10mol/L,c(H+)=$\frac{1{0}^{-14}}{\root{3}{7}×1{0}^{-10}}$mol/L,pH=-lgc(H+)=-lg$\frac{1{0}^{-14}}{\root{3}{7}×1{0}^{-10}}$=4.28,故加硫酸调pH的最大值是4.28,
故答案为:4.28;
(5)根据信息,GaO2-在阴极得电子电解金属镍,阴极的电极反应式是:GaO2-+3e-+2H2O=Ga+4OH-,
故答案为:GaO2-+3e-+2H2O=Ga+4OH-;
(6)制得Na3AsO4⋅12H2O用到的是冷却结晶的方法,具体的操作为:蒸发浓缩,降温结晶,过滤,洗涤,低温干燥,
故答案为:蒸发浓缩(或加热浓缩);低温干燥;
(7)根据电流由C2流向C1,可知C2是正极,C1是负极,
a.电子流向与电流流向相反,所以实验开始时,电子由C1经电流表流向C2,电子不能通过盐桥,故a错误;
b.图2中,b点电流为0,所以此时反应达到化学平衡状态,故b正确;
c.向左边烧杯中加入盐酸后会消耗OH-,AsO33-(aq)+I2(aq)+2OH-(aq)⇌AsO43-(aq)+2I-(aq)+H2O(l),平衡逆向移动,故c正确;
d.若将所加的盐酸换成氢氧化钠溶液,增大了OH-浓度,AsO33-(aq)+I2(aq)+2OH-(aq)⇌AsO43-(aq)+2I-(aq)+H2O(l)平衡正向移动,电流增大,故d错误;
故答案为:bc。
故答案为:Ga3++3OH-⇌Ga(OH)3⇌H2O+H++GaO2-;
(2)“浆化”过程将砷化镓废料转变为悬浊液,目的是:增大固液接触面积,提高碱浸速率,
故答案为:增大固液接触面积,提高碱浸速率;
(3)“碱浸1”过程加入了NaOH是碱性环境,加入的H2O2体现氧化性,砷化镓转化为NaGaO2和Na3AsO4,所以该反应的离子方程式:GaAs+4OH-+4H2O2=GaO2-+AsO43-+6H2O,
故答案为:GaAs+4OH-+4H2O2=GaO2-+AsO43-+6H2O;
(4)根据要求溶液中含镓元素的微粒的浓度不大于1.0×10-6时,认为该微粒沉淀完全,则溶液的pH大于GaO2-完全沉淀的pH,小于Ga(OH)3开始溶解的pH,Ksp[Ga(OH)3]=7.0×10-36,则c(OH-)=$\root{3}{\frac{{K}_{sp}[Ga(OH)_{3}]}{1{0}^{-6}}}$=$\root{3}{\frac{7.0×1{0}^{-36}}{1{0}^{-6}}}$=$\root{3}{7}$×10-10mol/L,c(H+)=$\frac{1{0}^{-14}}{\root{3}{7}×1{0}^{-10}}$mol/L,pH=-lgc(H+)=-lg$\frac{1{0}^{-14}}{\root{3}{7}×1{0}^{-10}}$=4.28,故加硫酸调pH的最大值是4.28,
故答案为:4.28;
(5)根据信息,GaO2-在阴极得电子电解金属镍,阴极的电极反应式是:GaO2-+3e-+2H2O=Ga+4OH-,
故答案为:GaO2-+3e-+2H2O=Ga+4OH-;
(6)制得Na3AsO4⋅12H2O用到的是冷却结晶的方法,具体的操作为:蒸发浓缩,降温结晶,过滤,洗涤,低温干燥,
故答案为:蒸发浓缩(或加热浓缩);低温干燥;
(7)根据电流由C2流向C1,可知C2是正极,C1是负极,
a.电子流向与电流流向相反,所以实验开始时,电子由C1经电流表流向C2,电子不能通过盐桥,故a错误;
b.图2中,b点电流为0,所以此时反应达到化学平衡状态,故b正确;
c.向左边烧杯中加入盐酸后会消耗OH-,AsO33-(aq)+I2(aq)+2OH-(aq)⇌AsO43-(aq)+2I-(aq)+H2O(l),平衡逆向移动,故c正确;
d.若将所加的盐酸换成氢氧化钠溶液,增大了OH-浓度,AsO33-(aq)+I2(aq)+2OH-(aq)⇌AsO43-(aq)+2I-(aq)+H2O(l)平衡正向移动,电流增大,故d错误;
故答案为:bc。