题目
(24) -P P=P 和 P=P 的键焓分别为 cdot mo(l)^-1 cdot mo(l)^-1-|||-cdot mo(l)^-1 从这一变化趋势看,通常条件下,正四面体P4分子要比 P=P 分子-|||-(A)更稳定 (B)更不稳定 (C)一样稳定

题目解答
答案
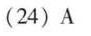
解析
步骤 1:理解键焓的概念
键焓是指在标准状态下,将1摩尔的分子中的化学键完全断裂成气态原子所需要的能量。键焓越大,表示该化学键越稳定,因为需要更多的能量才能将其断裂。
步骤 2:比较键焓
根据题目给出的数据,P-P键的键焓为$200kJ\cdot {mol}^{-1}$,P=P键的键焓为$310kJ\cdot {mol}^{-1}$,$P\equiv P$键的键焓为$490kJ\cdot {mol}^{-1}$。可以看出,随着键的多重性增加,键焓也增加,这表明多重键比单键更稳定。
步骤 3:分析P4分子的稳定性
正四面体P4分子中的P-P键的键焓为$200kJ\cdot {mol}^{-1}$,而P=P分子中的P=P键的键焓为$310kJ\cdot {mol}^{-1}$。由于P4分子中的P-P键的键焓小于P=P分子中的P=P键的键焓,因此P4分子比P=P分子更稳定。
键焓是指在标准状态下,将1摩尔的分子中的化学键完全断裂成气态原子所需要的能量。键焓越大,表示该化学键越稳定,因为需要更多的能量才能将其断裂。
步骤 2:比较键焓
根据题目给出的数据,P-P键的键焓为$200kJ\cdot {mol}^{-1}$,P=P键的键焓为$310kJ\cdot {mol}^{-1}$,$P\equiv P$键的键焓为$490kJ\cdot {mol}^{-1}$。可以看出,随着键的多重性增加,键焓也增加,这表明多重键比单键更稳定。
步骤 3:分析P4分子的稳定性
正四面体P4分子中的P-P键的键焓为$200kJ\cdot {mol}^{-1}$,而P=P分子中的P=P键的键焓为$310kJ\cdot {mol}^{-1}$。由于P4分子中的P-P键的键焓小于P=P分子中的P=P键的键焓,因此P4分子比P=P分子更稳定。