题目
8-9化学材料的研发和使用,为开发太阳能资源,寻求经济发展的新动力提供有力支撑,请根据你所学知识回答:(1)太阳能热水器吸热涂层常使用一种以镍或镍合金空心球做吸收剂,则基态镍原子的外围电子排布式 ____ .(2)由氧、镍和碳三种元素组成的化合物四碳基镍[Ni(CO)4]为无色挥发性剧毒液体,熔点-25℃,沸点43℃.不溶于水,易溶于乙醇、乙醚、苯、四氯化碳等有机溶剂,四碳基镍的晶体类型是 ____ ,写出一种与配体等电子体的化学式 ____ .(3)三氟化氮在太阳能电池制造中得到广泛应用.它可在铜的催化作用下由F2和过量的NH3反应得到,该反应的化学方程式为3F2+4NH3=NF3+3NH4F,生成物NH4F固体所含化学键类型是 ____ .往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+配离子.已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是 ____ .(4)多元化合物薄膜太阳能电池材料为无机盐,其主要包括砷化镓、硒化镓、硫化锌薄膜电池等.①砷和稼的第一电离能关系为:As ____ Ga(填“>”、“<”或“=”)②SeO2分子的空间构型为 ____ .③硫化锌的晶胞结构如图所示,锌离子的配位数是 ____ .已知此晶胞立方体的边长为a pm,晶体的密度为ρg/cm3,则阿伏加德罗常数可表示为 ____ mol-1(用含a、ρ的代数式表示).
 化学材料的研发和使用,为开发太阳能资源,寻求经济发展的新动力提供有力支撑,请根据你所学知识回答:
化学材料的研发和使用,为开发太阳能资源,寻求经济发展的新动力提供有力支撑,请根据你所学知识回答:(1)太阳能热水器吸热涂层常使用一种以镍或镍合金空心球做吸收剂,则基态镍原子的外围电子排布式 ____ .
(2)由氧、镍和碳三种元素组成的化合物四碳基镍[Ni(CO)4]为无色挥发性剧毒液体,熔点-25℃,沸点43℃.不溶于水,易溶于乙醇、乙醚、苯、四氯化碳等有机溶剂,四碳基镍的晶体类型是 ____ ,写出一种与配体等电子体的化学式 ____ .
(3)三氟化氮在太阳能电池制造中得到广泛应用.它可在铜的催化作用下由F2和过量的NH3反应得到,该反应的化学方程式为3F2+4NH3=NF3+3NH4F,生成物NH4F固体所含化学键类型是 ____ .往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+配离子.已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是 ____ .
(4)多元化合物薄膜太阳能电池材料为无机盐,其主要包括砷化镓、硒化镓、硫化锌薄膜电池等.
①砷和稼的第一电离能关系为:As ____ Ga(填“>”、“<”或“=”)
②SeO2分子的空间构型为 ____ .
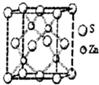
③硫化锌的晶胞结构如图所示,锌离子的配位数是 ____ .
已知此晶胞立方体的边长为a pm,晶体的密度为ρg/cm3,则阿伏加德罗常数可表示为 ____ mol-1(用含a、ρ的代数式表示).
题目解答
答案
解:(1)镍是28号元素,原子核外有28个电子,根据构造原理基态镍原子的核外电子排布式为[Ar]3d84s2,外围电子排布式为3d84s2,故答案为:3d84s2;
(2)四碳基镍熔沸点较低,易溶于有机溶剂,属于分子晶体,CO与N2分子中都含有2个原子,电子总数分别为14、14,互为等电子体,答案为:分子晶体;N2;
(3)NH4F是离子化合物,铵根离子中含有共价键、配位键;N、F、H三种元素的电负性:F>N>H,在NF3中,共用电子对偏向F,偏离N原子,导致NF3中N原子核对其孤对电子的吸引能力增强,难以形成配位键,故NF3不易与Cu2+形成配离子;
故答案为:离子键、共价键(配位键);F的电负性比N大,N-F成键电子对向F偏移,导致NF3中N原子核对其孤对电子的吸引能力增强,难以形成配位键,故NF3不易与Cu2+形成配离子;
(4)①同一周期随原子序数增大元素第一电离能呈增大趋势,As原子4p能级为半满稳定状态,能量较低,第一电离能高于同周期相邻元素的,故第一电离能As>Se,故答案为:>;
②二氧化硒分子中Se原子孤电子对数=$\frac{6-2×2}{2}$=1,价层电子对数=2+1=3,所以其空间构型是V形,故答案为:V形;
③根据图片知,每个Zn离子连接4个S离子,所以其配位数是4;
晶胞中Zn原子数目为4,S原子数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,晶胞质量为4×$\frac{65+32}{{N}_{A}}$g,晶胞体积V=(a×10-10cm)3,则4×$\frac{65+32}{{N}_{A}}$g=(a×10-10cm)3×ρg/cm3,整理可得NA=$\frac{388×1{0}^{30}}{ρ{a}^{3}}$,
故答案为:$\frac{388×1{0}^{30}}{ρ{a}^{3}}$.
(2)四碳基镍熔沸点较低,易溶于有机溶剂,属于分子晶体,CO与N2分子中都含有2个原子,电子总数分别为14、14,互为等电子体,答案为:分子晶体;N2;
(3)NH4F是离子化合物,铵根离子中含有共价键、配位键;N、F、H三种元素的电负性:F>N>H,在NF3中,共用电子对偏向F,偏离N原子,导致NF3中N原子核对其孤对电子的吸引能力增强,难以形成配位键,故NF3不易与Cu2+形成配离子;
故答案为:离子键、共价键(配位键);F的电负性比N大,N-F成键电子对向F偏移,导致NF3中N原子核对其孤对电子的吸引能力增强,难以形成配位键,故NF3不易与Cu2+形成配离子;
(4)①同一周期随原子序数增大元素第一电离能呈增大趋势,As原子4p能级为半满稳定状态,能量较低,第一电离能高于同周期相邻元素的,故第一电离能As>Se,故答案为:>;
②二氧化硒分子中Se原子孤电子对数=$\frac{6-2×2}{2}$=1,价层电子对数=2+1=3,所以其空间构型是V形,故答案为:V形;
③根据图片知,每个Zn离子连接4个S离子,所以其配位数是4;
晶胞中Zn原子数目为4,S原子数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,晶胞质量为4×$\frac{65+32}{{N}_{A}}$g,晶胞体积V=(a×10-10cm)3,则4×$\frac{65+32}{{N}_{A}}$g=(a×10-10cm)3×ρg/cm3,整理可得NA=$\frac{388×1{0}^{30}}{ρ{a}^{3}}$,
故答案为:$\frac{388×1{0}^{30}}{ρ{a}^{3}}$.