题目
在温度为20℃、总压为101.3kPa的条件下,SO2与空气混合气缓慢地沿着某碱溶液的液面流过,空气不溶于该溶液。SO2透过1mm厚的静止空气层扩散到溶液中,混合气体中SO2的摩尔分率为0.2,SO2到达溶液液面上立即被吸收,故相界面上SO2的浓度可忽略不计。已知温度20℃时,SO2在空气中的扩散系数为0.18cm2/s。试求SO2的传质速率为多少?
在温度为20℃、总压为101.3kPa的条件下,SO2与空气混合气缓慢地沿着某碱溶液的液面流过,空气不溶于该溶液。SO2透过1mm厚的静止空气层扩散到溶液中,混合气体中SO2的摩尔分率为0.2,SO2到达溶液液面上立即被吸收,故相界面上SO2的浓度可忽略不计。已知温度20℃时,SO2在空气中的扩散系数为0.18cm2/s。试求SO2的传质速率为多少?
题目解答
答案
解 : SO2通过静止空气层扩散到溶液液面属单向扩散,已知:SO2在空气中的扩散系数D=0.18cm2/s=1.8×10-5m2/s
扩散距离z=1mm=0.001m,气相总压p=101.3kPa
气相主体中溶质SO2的分压pA1=p·yA1=101.3×0.2=20.26kPa
气液界面上SO2的分压pA2=0
所以,气相主体中空气(惰性组分)的分压pB1=p-pA1=101.3-20.26=81.04kPa
气液界面上的空气(惰性组分)的分压pB2=p-pA2=101.3-0=101.3kPa
空气在气相主体和界面上分压的对数平均值为:
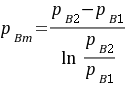 =
=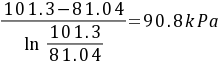
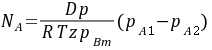
=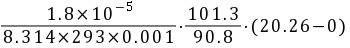
=1.67×10-4kmol/(m2·s)
解析
步骤 1:确定已知条件
- 温度:20℃
- 总压:101.3kPa
- SO2的摩尔分率:0.2
- SO2在空气中的扩散系数:0.18cm2/s
- 扩散距离:1mm
- SO2到达溶液液面上立即被吸收,相界面上SO2的浓度可忽略不计
步骤 2:计算SO2在空气中的分压
- SO2的分压:pA1 = p·yA1 = 101.3kPa × 0.2 = 20.26kPa
- 空气的分压:pB1 = p - pA1 = 101.3kPa - 20.26kPa = 81.04kPa
步骤 3:计算空气在气相主体和界面上分压的对数平均值
- 空气在气相主体和界面上分压的对数平均值:${P}_{Bm}=\dfrac {{P}_{B2}-{P}_{B1}}{\ln \dfrac {{P}_{B2}}{{P}_{BI}}}$=$\dfrac {101.3-81.04}{\ln \dfrac {101.3}{81.04}}=90.8kPa$
步骤 4:计算SO2的传质速率
- SO2的传质速率:${N}_{A}=\dfrac {DP}{RTZ{P}_{BM}}({P}_{A1}-{P}_{A2})$
- 将已知条件代入公式:${N}_{A}=\dfrac {1.8\times {10}^{-5}}{8.314\times 293\times 0.001}\cdot \dfrac {101.3}{90.8}\cdot (20.26-0)$
- 计算结果:${N}_{A}=1.67\times {10}^{-4}kmol/(m^{2}\cdot s)$
- 温度:20℃
- 总压:101.3kPa
- SO2的摩尔分率:0.2
- SO2在空气中的扩散系数:0.18cm2/s
- 扩散距离:1mm
- SO2到达溶液液面上立即被吸收,相界面上SO2的浓度可忽略不计
步骤 2:计算SO2在空气中的分压
- SO2的分压:pA1 = p·yA1 = 101.3kPa × 0.2 = 20.26kPa
- 空气的分压:pB1 = p - pA1 = 101.3kPa - 20.26kPa = 81.04kPa
步骤 3:计算空气在气相主体和界面上分压的对数平均值
- 空气在气相主体和界面上分压的对数平均值:${P}_{Bm}=\dfrac {{P}_{B2}-{P}_{B1}}{\ln \dfrac {{P}_{B2}}{{P}_{BI}}}$=$\dfrac {101.3-81.04}{\ln \dfrac {101.3}{81.04}}=90.8kPa$
步骤 4:计算SO2的传质速率
- SO2的传质速率:${N}_{A}=\dfrac {DP}{RTZ{P}_{BM}}({P}_{A1}-{P}_{A2})$
- 将已知条件代入公式:${N}_{A}=\dfrac {1.8\times {10}^{-5}}{8.314\times 293\times 0.001}\cdot \dfrac {101.3}{90.8}\cdot (20.26-0)$
- 计算结果:${N}_{A}=1.67\times {10}^{-4}kmol/(m^{2}\cdot s)$