题目
下列表达方式不正确的是A.H2O的电子式:B.基态N原子的价层电子排布图:C.基态s原子的结构示意图:D.基态Fe2+的价层电子排布式为:[Ar]3d44s2
下列表达方式不正确的是
A.H2O的电子式: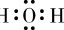 |
B.基态N原子的价层电子排布图: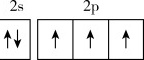 |
C.基态s原子的结构示意图: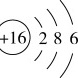 |
| D.基态Fe2+的价层电子排布式为:[Ar]3d44s2 |
题目解答
答案

解析
步骤 1:分析选项A
H_2O的电子式:H:O:H,这个电子式表示了氧原子与两个氢原子通过共用电子对形成水分子,是正确的。
步骤 2:分析选项B
基态N原子的价层电子排布图:2s 2p ↑↓ ↑ ↑ ↑,这个排布图表示了氮原子的价层电子排布,其中2s轨道上有一个电子,2p轨道上有三个电子,是正确的。
步骤 3:分析选项C
基态S原子的结构示意图:+16) 286,这个结构示意图表示了硫原子的电子排布,其中硫原子的电子排布为1s^2 2s^2 2p^6 3s^2 3p^4,是正确的。
步骤 4:分析选项D
基态Fe^{2+}的价层电子排布式为:[Ar]3d^{4}4s^{2},这个排布式表示了铁离子的价层电子排布,其中铁离子的电子排布为1s^2 2s^2 2p^6 3s^2 3p^6 3d^6 4s^2,失去两个电子后,电子排布为1s^2 2s^2 2p^6 3s^2 3p^6 3d^6,因此,正确的价层电子排布式为[Ar]3d^6,而不是[Ar]3d^4 4s^2。
H_2O的电子式:H:O:H,这个电子式表示了氧原子与两个氢原子通过共用电子对形成水分子,是正确的。
步骤 2:分析选项B
基态N原子的价层电子排布图:2s 2p ↑↓ ↑ ↑ ↑,这个排布图表示了氮原子的价层电子排布,其中2s轨道上有一个电子,2p轨道上有三个电子,是正确的。
步骤 3:分析选项C
基态S原子的结构示意图:+16) 286,这个结构示意图表示了硫原子的电子排布,其中硫原子的电子排布为1s^2 2s^2 2p^6 3s^2 3p^4,是正确的。
步骤 4:分析选项D
基态Fe^{2+}的价层电子排布式为:[Ar]3d^{4}4s^{2},这个排布式表示了铁离子的价层电子排布,其中铁离子的电子排布为1s^2 2s^2 2p^6 3s^2 3p^6 3d^6 4s^2,失去两个电子后,电子排布为1s^2 2s^2 2p^6 3s^2 3p^6 3d^6,因此,正确的价层电子排布式为[Ar]3d^6,而不是[Ar]3d^4 4s^2。