题目
已知在1 mol.L-1HCl介质中,Fe(Ⅲ)/Fe(Ⅱ)电对的E⊙’=0.70V,Sn(Ⅳ)/Sn(Ⅱ)电对的E⊙’=0.14V。求在此条件下,反应2 Fe3++ Sn2+=== Sn4++2 Fe2+的条件平衡常数。
已知在1 mol.L-1HCl介质中,Fe(Ⅲ)/Fe(Ⅱ)电对的E⊙’=0.70V,Sn(Ⅳ)/Sn(Ⅱ)电对的E⊙’=0.14V。求在此条件下,反应2 Fe3++ Sn2+=== Sn4++2 Fe2+的条件平衡常数。
题目解答
答案
解: Fe3+ + e  Fe2+ E⊙’=0.70V
Fe2+ E⊙’=0.70V
Sn4+ + 2e  Sn2+ E⊙’=0.14V
Sn2+ E⊙’=0.14V
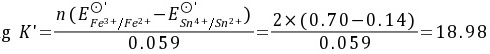
K’= 1018.98=9.55×1018
解析
步骤 1:确定电对的电极电势
在1 mol.L-1 HCl介质中,Fe(Ⅲ)/Fe(Ⅱ)电对的条件电极电势E⊙’(Fe³⁺/Fe²⁺) = 0.70V,Sn(Ⅳ)/Sn(Ⅱ)电对的条件电极电势E⊙’(Sn⁴⁺/Sn²⁺) = 0.14V。
步骤 2:计算反应的条件电势差
反应2 Fe³⁺ + Sn²⁺ === Sn⁴⁺ + 2 Fe²⁺的条件电势差ΔE⊙’ = E⊙’(Sn⁴⁺/Sn²⁺) - E⊙’(Fe³⁺/Fe²⁺) = 0.14V - 0.70V = -0.56V。
步骤 3:计算反应的条件平衡常数
根据能斯特方程,反应的条件平衡常数K’与条件电势差ΔE⊙’的关系为:ΔE⊙’ = (RT/nF) ln K’,其中R为气体常数,T为温度,n为电子转移数,F为法拉第常数。在25℃时,R = 8.314 J/(mol·K),T = 298.15 K,n = 2,F = 96485 C/mol。代入上述公式,得到:-0.56V = (8.314 J/(mol·K) × 298.15 K / (2 × 96485 C/mol)) ln K’,解得K’ = 10^18.98 = 9.55×10^18。
在1 mol.L-1 HCl介质中,Fe(Ⅲ)/Fe(Ⅱ)电对的条件电极电势E⊙’(Fe³⁺/Fe²⁺) = 0.70V,Sn(Ⅳ)/Sn(Ⅱ)电对的条件电极电势E⊙’(Sn⁴⁺/Sn²⁺) = 0.14V。
步骤 2:计算反应的条件电势差
反应2 Fe³⁺ + Sn²⁺ === Sn⁴⁺ + 2 Fe²⁺的条件电势差ΔE⊙’ = E⊙’(Sn⁴⁺/Sn²⁺) - E⊙’(Fe³⁺/Fe²⁺) = 0.14V - 0.70V = -0.56V。
步骤 3:计算反应的条件平衡常数
根据能斯特方程,反应的条件平衡常数K’与条件电势差ΔE⊙’的关系为:ΔE⊙’ = (RT/nF) ln K’,其中R为气体常数,T为温度,n为电子转移数,F为法拉第常数。在25℃时,R = 8.314 J/(mol·K),T = 298.15 K,n = 2,F = 96485 C/mol。代入上述公式,得到:-0.56V = (8.314 J/(mol·K) × 298.15 K / (2 × 96485 C/mol)) ln K’,解得K’ = 10^18.98 = 9.55×10^18。