题目
二氧化锰因应用广泛而备受关注。某研究小组采用如图装置通过焙烧MnCO3制取MnO2,发生反应的化学方程式为:2MnCO3+O2(underline(;△;))/(;)2CO2+2MnO2。↑剩余固体的质量 /g-|||-46.0 MnCO3-|||-MnO2-|||-石英管MnCO3-|||-空气 =-|||-管式炉 澄清-|||-石灰-|||-水-|||-A-|||-Mn2O3-|||-MnO-|||-0 300 600 900 温度/(1)MnO2→MnO固体中 ____ 元素的质量减少。(2)加热至 ____ ℃时,MnO2开始分解。(3)根据化学方程式求46.0gMnCO3通过焙烧最多制得的MnO2的质量是多少?(请写出计算过程)(4)A点的固体物质成分是 ____ (填化学式)。
二氧化锰因应用广泛而备受关注。某研究小组采用如图装置通过焙烧MnCO3制取MnO2,发生反应的化学方程式为:2MnCO3+O2$\frac{\underline{\;△\;}}{\;}$2CO2+2MnO2。
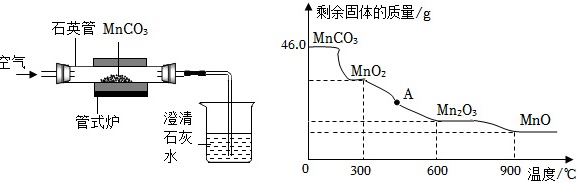
(1)MnO2→MnO固体中 ____ 元素的质量减少。
(2)加热至 ____ ℃时,MnO2开始分解。
(3)根据化学方程式求46.0gMnCO3通过焙烧最多制得的MnO2的质量是多少?(请写出计算过程)
(4)A点的固体物质成分是 ____ (填化学式)。

(1)MnO2→MnO固体中 ____ 元素的质量减少。
(2)加热至 ____ ℃时,MnO2开始分解。
(3)根据化学方程式求46.0gMnCO3通过焙烧最多制得的MnO2的质量是多少?(请写出计算过程)
(4)A点的固体物质成分是 ____ (填化学式)。
题目解答
答案
解:(1)MnO2中锰元素与氧元素的质量比为55:(16×2)=55:32,MnO中锰元素与氧元素的质量比为55:16=55:16,所以MnO2→MnO固体中氧元素的质量减少。
(2)由图可知,加热至300℃时,MnO2开始分解。
(3)设最多制得的MnO2的质量是x。
2MnCO3+O2$\frac{\underline{\;△\;}}{\;}$2CO2+2MnO2
230 174
46g x
$\frac{230}{174}=\frac{46g}{x}$
x=34.8g
答:最多制得的MnO2的质量是34.8g。
(4)由图可知,A点时MnO2没有完全分解,固体物质成分是MnO2和Mn2O3的混合物。
故答案为:
(1)氧;
(2)300;
(3)34.8g;
(4)MnO2、Mn2O3。
(2)由图可知,加热至300℃时,MnO2开始分解。
(3)设最多制得的MnO2的质量是x。
2MnCO3+O2$\frac{\underline{\;△\;}}{\;}$2CO2+2MnO2
230 174
46g x
$\frac{230}{174}=\frac{46g}{x}$
x=34.8g
答:最多制得的MnO2的质量是34.8g。
(4)由图可知,A点时MnO2没有完全分解,固体物质成分是MnO2和Mn2O3的混合物。
故答案为:
(1)氧;
(2)300;
(3)34.8g;
(4)MnO2、Mn2O3。
解析
- 元素质量变化比较:通过比较MnO₂和MnO中氧元素的质量占比,判断转化过程中减少的元素。
- 分解温度判断:根据固体质量变化曲线的拐点,确定MnO₂开始分解的温度。
- 化学方程式计算:利用质量守恒定律,通过反应物与生成物的摩尔比计算生成物质量。
- 固体成分分析:结合分解温度区间和固体残留物变化,推断A点对应固体的组成。
第(1)题
元素质量比计算
- MnO₂中氧元素质量比:$\frac{16 \times 2}{55 + 16 \times 2} = \frac{32}{87}$
- MnO中氧元素质量比:$\frac{16}{55 + 16} = \frac{16}{71}$
- 结论:氧元素的质量占比减少。
第(2)题
图像拐点分析
- 固体质量在300℃时开始下降,说明此时MnO₂开始分解。
第(3)题
设定未知数
设最多生成MnO₂的质量为$x$。
摩尔比关系
根据化学方程式,$2\ \text{MnCO}_3 \sim 2\ \text{MnO}_2$,即质量比为$230:174$。
列比例式
$\frac{230}{46.0} = \frac{174}{x} \implies x = \frac{46.0 \times 174}{230} = 34.8\ \text{g}$
第(4)题
分解阶段分析
- A点温度在300℃到600℃之间,此时MnO₂部分分解为Mn₂O₃,固体为两者的混合物。