题目
4.二级反应的速率常数的单位是 ()-|||-A. ^-1 B. (m)^6cdot (s)^-1cdot (mol)^-2-|||-C. ^-1cdot (mol)^-2 D. ^3cdot (s)^-1cdot (mol)^-1
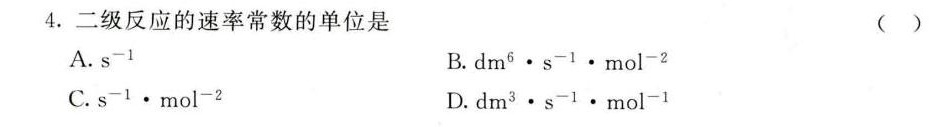
题目解答
答案
解析
步骤 1:理解二级反应的定义
二级反应是指反应速率与反应物浓度的平方成正比的反应。其速率方程可以表示为 $v = k[A]^2$,其中 $v$ 是反应速率,$k$ 是速率常数,$[A]$ 是反应物的浓度。
步骤 2:确定速率常数的单位
根据速率方程 $v = k[A]^2$,反应速率 $v$ 的单位是 ${mol}\cdot{dm}^{-3}\cdot{s}^{-1}$(摩尔每立方分米每秒),反应物浓度 $[A]$ 的单位是 ${mol}\cdot{dm}^{-3}$(摩尔每立方分米)。因此,速率常数 $k$ 的单位可以通过速率方程的单位平衡来确定。
步骤 3:计算速率常数的单位
将速率方程的单位代入,得到 ${mol}\cdot{dm}^{-3}\cdot{s}^{-1} = k \cdot ({mol}\cdot{dm}^{-3})^2$。通过单位平衡,可以解出速率常数 $k$ 的单位为 ${dm}^{3}\cdot{s}^{-1}\cdot{mol}^{-1}$。
二级反应是指反应速率与反应物浓度的平方成正比的反应。其速率方程可以表示为 $v = k[A]^2$,其中 $v$ 是反应速率,$k$ 是速率常数,$[A]$ 是反应物的浓度。
步骤 2:确定速率常数的单位
根据速率方程 $v = k[A]^2$,反应速率 $v$ 的单位是 ${mol}\cdot{dm}^{-3}\cdot{s}^{-1}$(摩尔每立方分米每秒),反应物浓度 $[A]$ 的单位是 ${mol}\cdot{dm}^{-3}$(摩尔每立方分米)。因此,速率常数 $k$ 的单位可以通过速率方程的单位平衡来确定。
步骤 3:计算速率常数的单位
将速率方程的单位代入,得到 ${mol}\cdot{dm}^{-3}\cdot{s}^{-1} = k \cdot ({mol}\cdot{dm}^{-3})^2$。通过单位平衡,可以解出速率常数 $k$ 的单位为 ${dm}^{3}\cdot{s}^{-1}\cdot{mol}^{-1}$。