题目
20.草酸钙在 =2 的溶液中的溶解度 ()-|||-A.等于 sqrt ({K)_(sp)} B.小于 sqrt ({K)_(sp)} C.大于 sqrt ({K)_(sp)} D.大于pH4溶液中的溶解度
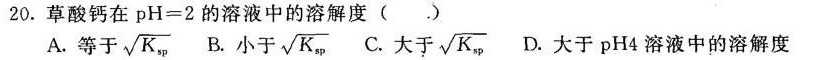
题目解答
答案
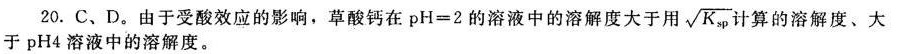
解析
步骤 1:理解酸效应
酸效应是指在酸性溶液中,某些难溶电解质的溶解度会增加的现象。这是因为酸性溶液中的氢离子(H+)会与难溶电解质中的阴离子结合,形成弱电解质或非电解质,从而降低阴离子的浓度,使难溶电解质的溶解平衡向溶解方向移动,增加其溶解度。
步骤 2:草酸钙的溶解平衡
草酸钙(CaC2O4)在水中的溶解平衡可以表示为:
\[ \text{CaC}_2\text{O}_4(s) \rightleftharpoons \text{Ca}^{2+}(aq) + \text{C}_2\text{O}_4^{2-}(aq) \]
其溶度积常数(Ksp)为:
\[ K_{sp} = [\text{Ca}^{2+}][\text{C}_2\text{O}_4^{2-}] \]
步骤 3:酸性溶液中草酸钙的溶解度
在pH=2的酸性溶液中,氢离子(H+)会与草酸根离子(C2O4^2-)结合,形成草酸(H2C2O4):
\[ \text{H}^+ + \text{C}_2\text{O}_4^{2-} \rightarrow \text{HC}_2\text{O}_4^- \]
\[ \text{H}^+ + \text{HC}_2\text{O}_4^- \rightarrow \text{H}_2\text{C}_2\text{O}_4 \]
由于草酸是弱电解质,其在溶液中的浓度远小于草酸根离子的浓度,因此在酸性溶液中,草酸根离子的浓度会降低,从而增加草酸钙的溶解度。
步骤 4:比较不同pH值溶液中的溶解度
由于pH=2的溶液比pH=4的溶液酸性更强,因此在pH=2的溶液中,草酸钙的溶解度会更大。
酸效应是指在酸性溶液中,某些难溶电解质的溶解度会增加的现象。这是因为酸性溶液中的氢离子(H+)会与难溶电解质中的阴离子结合,形成弱电解质或非电解质,从而降低阴离子的浓度,使难溶电解质的溶解平衡向溶解方向移动,增加其溶解度。
步骤 2:草酸钙的溶解平衡
草酸钙(CaC2O4)在水中的溶解平衡可以表示为:
\[ \text{CaC}_2\text{O}_4(s) \rightleftharpoons \text{Ca}^{2+}(aq) + \text{C}_2\text{O}_4^{2-}(aq) \]
其溶度积常数(Ksp)为:
\[ K_{sp} = [\text{Ca}^{2+}][\text{C}_2\text{O}_4^{2-}] \]
步骤 3:酸性溶液中草酸钙的溶解度
在pH=2的酸性溶液中,氢离子(H+)会与草酸根离子(C2O4^2-)结合,形成草酸(H2C2O4):
\[ \text{H}^+ + \text{C}_2\text{O}_4^{2-} \rightarrow \text{HC}_2\text{O}_4^- \]
\[ \text{H}^+ + \text{HC}_2\text{O}_4^- \rightarrow \text{H}_2\text{C}_2\text{O}_4 \]
由于草酸是弱电解质,其在溶液中的浓度远小于草酸根离子的浓度,因此在酸性溶液中,草酸根离子的浓度会降低,从而增加草酸钙的溶解度。
步骤 4:比较不同pH值溶液中的溶解度
由于pH=2的溶液比pH=4的溶液酸性更强,因此在pH=2的溶液中,草酸钙的溶解度会更大。