题目
在25℃时,将水中的一切杂质除去,水的电导率将是多少?25℃时水的离子积 _(W)=-|||-^+(Co{H)^-}=1.008times (10)^-14 下列各电解质的极限当量电导分别为: (lambda )_(0)(kOH)=274.4(S{C)_(m)}^2/cq,-|||-(lambda )_(0)(HCl)=426.04(S{)_(2)}^2/eq, (lambda )_(0)(KCl)=149.82(S)_(cm)^2/cq

题目解答
答案
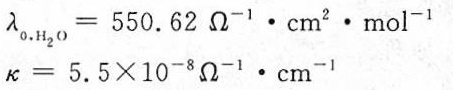
解析
步骤 1:确定水的离子积和极限当量电导
在25℃时,水的离子积 ${K}_{W}=$ ${C}_{{H}^{+}}{C}_{{OH}^{-}}=1.008\times {10}^{-14}$。极限当量电导是电解质在完全电离时的电导率,对于水,我们考虑的是 ${\lambda }_{0}(HCl)$ 和 ${\lambda }_{0}(KOH)$,因为它们分别代表了 ${H}^{+}$ 和 ${OH}^{-}$ 的极限当量电导。
步骤 2:计算水的极限摩尔电导率
水的极限摩尔电导率 ${\lambda }_{0}(H_{2}O)$ 可以通过 ${\lambda }_{0}(HCl)$ 和 ${\lambda }_{0}(KOH)$ 的极限当量电导来计算,因为 ${\lambda }_{0}(H_{2}O) = {\lambda }_{0}(HCl) + {\lambda }_{0}(KOH) - {\lambda }_{0}(KCl)$。这是因为 ${\lambda }_{0}(KCl)$ 是 ${K}^{+}$ 和 ${Cl}^{-}$ 的极限当量电导,而 ${\lambda }_{0}(HCl)$ 和 ${\lambda }_{0}(KOH)$ 分别是 ${H}^{+}$ 和 ${OH}^{-}$ 的极限当量电导,它们的和减去 ${\lambda }_{0}(KCl)$ 就是水的极限摩尔电导率。
步骤 3:计算水的电导率
水的电导率可以通过水的离子积 ${K}_{W}$ 和极限摩尔电导率 ${\lambda }_{0}(H_{2}O)$ 来计算。电导率 $k$ 可以通过公式 $k = \lambda_{0} \cdot C$ 计算,其中 $C$ 是水的浓度,对于纯水,$C = \sqrt{K_{W}}$。
在25℃时,水的离子积 ${K}_{W}=$ ${C}_{{H}^{+}}{C}_{{OH}^{-}}=1.008\times {10}^{-14}$。极限当量电导是电解质在完全电离时的电导率,对于水,我们考虑的是 ${\lambda }_{0}(HCl)$ 和 ${\lambda }_{0}(KOH)$,因为它们分别代表了 ${H}^{+}$ 和 ${OH}^{-}$ 的极限当量电导。
步骤 2:计算水的极限摩尔电导率
水的极限摩尔电导率 ${\lambda }_{0}(H_{2}O)$ 可以通过 ${\lambda }_{0}(HCl)$ 和 ${\lambda }_{0}(KOH)$ 的极限当量电导来计算,因为 ${\lambda }_{0}(H_{2}O) = {\lambda }_{0}(HCl) + {\lambda }_{0}(KOH) - {\lambda }_{0}(KCl)$。这是因为 ${\lambda }_{0}(KCl)$ 是 ${K}^{+}$ 和 ${Cl}^{-}$ 的极限当量电导,而 ${\lambda }_{0}(HCl)$ 和 ${\lambda }_{0}(KOH)$ 分别是 ${H}^{+}$ 和 ${OH}^{-}$ 的极限当量电导,它们的和减去 ${\lambda }_{0}(KCl)$ 就是水的极限摩尔电导率。
步骤 3:计算水的电导率
水的电导率可以通过水的离子积 ${K}_{W}$ 和极限摩尔电导率 ${\lambda }_{0}(H_{2}O)$ 来计算。电导率 $k$ 可以通过公式 $k = \lambda_{0} \cdot C$ 计算,其中 $C$ 是水的浓度,对于纯水,$C = \sqrt{K_{W}}$。