10.某小组通过实验研究Na2O2与水的反应,设计的实验及相关现象如下: 操作 现象 向盛有 4 g Na2O2的烧杯中加入 50 mL 蒸馏水得到溶液a 剧烈反应,产生能使带火星木条复燃的气体 取 5 mL 溶液a于试管中,滴入两滴酚酞 ⅰ.溶液变红 ⅱ.10分钟后溶液颜色明显变浅,稍后,溶液变为无色 (1)Na2O2与水反应的化学方程式为 。 (2)该小组同学认为ⅱ中溶液颜色明显变浅可能是溶液a中存在的较多的H2O2与酚酞发生了反应。Ⅰ.甲同学通过实验证实了H2O2的存在:取少量溶液a,加入试剂b,有气体产生。Ⅱ.乙同学查阅资料获悉:用KMnO4可以测定H2O2的含量。取15.00 mL溶液a,用稀H2SO4酸化,逐滴加入0.003mol·L-1KMnO4溶液,产生气体,溶液褪色速率开始较慢后变快,至终点时共消耗20.00 mLKMnO4溶液。①请配平: Mn+ H2O2+ Mn2++ O2↑+ H2O。②溶液a中c(H2O2)= mol·L-1,试剂b为 (填化学式)。 ③溶液褪色速率开始较慢后变快的原因可能是 。 (3)为探究现象ⅱ产生的原因,同学们继续进行了如下实验:Ⅲ.向H2O2溶液中滴入两滴酚酞,振荡,加入5滴0.1mol·L-1NaOH溶液,溶液变红又迅速变浅且产生气体,10min后溶液为无色。Ⅳ.向0.1mol·L-1NaOH溶液中滴入两滴酚酞,振荡,溶液变红,10min后溶液颜色无明显变化;向该溶液中通入O2,溶液颜色无明显变化。①从实验Ⅲ和Ⅳ中,可得出的结论是 。 ②同学们进一步通过实验证实了溶液a中滴入酚酞后,H2O2与酚酞发生了化学反应。实验方案是:取少量溶液a于试管中, 。 【解析】(1)实验现象“产生能使带火星木条复燃的气体”说明有氧气产生,溶液变红说明有碱生成,据此写出化学方程式:2Na2O2+2H2O4NaOH+O2↑。(2)Ⅰ.通常用MnO2作催化剂使H2O2反应生成气体。Ⅱ.①KMnO4与H2O2反应有气体产生,说明有氧气生成,溶液褪色说明KMnO4被还原,再根据得失电子守恒和电荷守恒可写出离子方程式为2Mn+5H2O2+6H+2Mn2++5O2↑+8H2O。②根据KMnO4与H2O2反应的离子方程式可知关系式为2Mn ~ 5H2O22 mol 5mol0.003 mol·L-1×0.02L n(H2O2)n(H2O2)=1.5×10-4mol;c(H2O2)==0.01mol·L-1。③一般情况下在开始时反应物浓度较大,反应速率应当较快,但现在是溶液褪色速率开始较慢后变快,则可能是产生新的物质,且此物质对反应有催化作用,从而加快了反应速率,根据离子反应2Mn+5H2O2+6H+2Mn2++5O2↑+8H2O可知,起催化作用的物质为Mn2+。
10.某小组通过实验研究Na2O2与水的反应,设计的实验及相关现象如下:
操作 | 现象 |
向盛有 4 g Na2O2的烧杯中加入 50 mL 蒸馏水得到溶液a | 剧烈反应,产生能使带火星木条复燃的气体 |
取 5 mL 溶液a于试管中,滴入两滴酚酞 | ⅰ.溶液变红 ⅱ.10分钟后溶液颜色明显变浅,稍后,溶液变为无色 |
(1)Na2O2与水反应的化学方程式为
。
(2)该小组同学认为ⅱ中溶液颜色明显变浅可能是溶液a中存在的较多的H2O2与酚酞发生了反应。
Ⅰ.甲同学通过实验证实了H2O2的存在:取少量溶液a,加入试剂b,有气体产生。
Ⅱ.乙同学查阅资料获悉:用KMnO4可以测定H2O2的含量。取15.00 mL溶液a,用稀H2SO4酸化,逐滴加入0.003mol·L-1KMnO4溶液,产生气体,溶液褪色速率开始较慢后变快,至终点时共消耗20.00 mLKMnO4溶液。
①请配平: Mn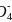 + H2O2+
+ H2O2+ ![]() Mn2++ O2↑+ H2O。
Mn2++ O2↑+ H2O。
②溶液a中c(H2O2)= mol·L-1,试剂b为 (填化学式)。
③溶液褪色速率开始较慢后变快的原因可能是 。
(3)为探究现象ⅱ产生的原因,同学们继续进行了如下实验:
Ⅲ.向H2O2溶液中滴入两滴酚酞,振荡,加入5滴0.1mol·L-1NaOH溶液,溶液变红又迅速变浅且产生气体,10min后溶液为无色。
Ⅳ.向0.1mol·L-1NaOH溶液中滴入两滴酚酞,振荡,溶液变红,10min后溶液颜色无明显变化;向该溶液中通入O2,溶液颜色无明显变化。
①从实验Ⅲ和Ⅳ中,可得出的结论是 。
②同学们进一步通过实验证实了溶液a中滴入酚酞后,H2O2与酚酞发生了化学反应。实验方案是:取少量溶液a于试管中, 。
【解析】(1)实验现象“产生能使带火星木条复燃的气体”说明有氧气产生,溶液变红说明有碱生成,据此写出化学方程式:2Na2O2+2H2O![]() 4NaOH+O2↑。
4NaOH+O2↑。
(2)Ⅰ.通常用MnO2作催化剂使H2O2反应生成气体。
Ⅱ.①KMnO4与H2O2反应有气体产生,说明有氧气生成,溶液褪色说明KMnO4被还原,再根据得失电子守恒和电荷守恒可写出离子方程式为2Mn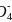 +5H2O2+6H+
+5H2O2+6H+![]() 2Mn2++5O2↑+8H2O。
2Mn2++5O2↑+8H2O。
②根据KMnO4与H2O2反应的离子方程式可知关系式为
2Mn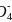 ~ 5H2O2
~ 5H2O2
2 mol 5mol
0.003 mol·L-1×0.02L n(H2O2)
n(H2O2)=1.5×10-4mol;c(H2O2)=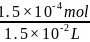 =0.01mol·L-1。
=0.01mol·L-1。
③一般情况下在开始时反应物浓度较大,反应速率应当较快,但现在是溶液褪色速率开始较慢后变快,则可能是产生新的物质,且此物质对反应有催化作用,从而加快了反应速率,根据离子反应2Mn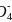 +5H2O2+6H+
+5H2O2+6H+![]() 2Mn2++5O2↑+8H2O可知,起催化作用的物质为Mn2+。
2Mn2++5O2↑+8H2O可知,起催化作用的物质为Mn2+。
题目解答
答案
【答案】(1)2Na2O2+2H2O![]() 4NaOH+O2↑
4NaOH+O2↑
(2)①2 5 6H+ 2 5 8
②0.01 MnO2
③反应生成的Mn2+作催化剂
(3)①碱性条件下,H2O2能与酚酞反应而O2不能
②加入MnO2,充分反应后,向上层清液中滴入2滴酚酞,振荡,溶液变红,10min后,溶液颜色无明显变化