题目
15.反应 (s)+CuS(O)_(4)(a=1)arrow Cu(s)+ZnS(O)_(4)(a=1) 在电池中进行,288K时,测得电动势 E=-|||-1.0934V,已知电池的温度系数 (dfrac (partial E)(partial T))=-4.29times (10)^-4Vcdot (k)^-1-|||-(1)写出该反应所对应电池的书面表示式和电极反应。-|||-(2)求电池反应的 Delta (G)_(m) (Delta )_(n)(S)_(m) Delta (H)_(m) 和QR

题目解答
答案
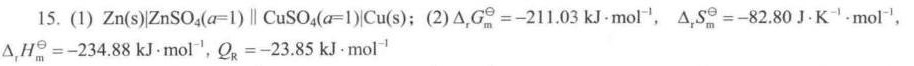
解析
步骤 1:电池的书面表示式和电极反应
根据反应方程式,可以写出电池的书面表示式为:$Zn(s)|ZnS{O}_{4}(a=1)||CuS{O}_{4}(a=1)|Cu(s)$。其中,左边为负极,发生氧化反应,右边为正极,发生还原反应。电极反应分别为:负极:$Zn(s)\rightarrow Zn^{2+}(aq)+2e^{-}$,正极:$Cu^{2+}(aq)+2e^{-}\rightarrow Cu(s)$。
步骤 2:计算电池反应的 ${\Delta }_{1}{G}_{m}$
根据公式 ${\Delta }_{1}{G}_{m}=-nFE$,其中 $n$ 为反应中转移的电子数,$F$ 为法拉第常数,$E$ 为电动势。代入已知条件,$n=2$,$F=96485C/mol$,$E=1.0934V$,计算得 ${\Delta }_{1}{G}_{m}=-211.03 kJ\cdot mol^{-1}$。
步骤 3:计算电池反应的 ${\Delta }_{1}{S}_{m}$
根据公式 ${\Delta }_{1}{S}_{m}=-nF(\dfrac {\partial E}{\partial T})$,代入已知条件,$n=2$,$F=96485C/mol$,$(\dfrac {\partial E}{\partial T})=-4.29\times {10}^{-4}V\cdot {k}^{-1}$,计算得 ${\Delta }_{1}{S}_{m}=-82.80J\cdot {K}^{-1}\cdot {mol}^{-1}$。
步骤 4:计算电池反应的 ${\Delta }_{1}{H}_{m}$
根据公式 ${\Delta }_{1}{H}_{m}={\Delta }_{1}{G}_{m}+T{\Delta }_{1}{S}_{m}$,代入已知条件,${\Delta }_{1}{G}_{m}=-211.03 kJ\cdot mol^{-1}$,${\Delta }_{1}{S}_{m}=-82.80J\cdot {K}^{-1}\cdot {mol}^{-1}$,$T=288K$,计算得 ${\Delta }_{1}{H}_{m}=-234.88kJ\cdot {mol}^{-1}$。
步骤 5:计算电池反应的 QR
根据公式 $QR={\Delta }_{1}{H}_{m}-{\Delta }_{1}{G}_{m}$,代入已知条件,${\Delta }_{1}{H}_{m}=-234.88kJ\cdot {mol}^{-1}$,${\Delta }_{1}{G}_{m}=-211.03 kJ\cdot mol^{-1}$,计算得 $QR=-23.85kJ\cdot {mol}^{-1}$。
根据反应方程式,可以写出电池的书面表示式为:$Zn(s)|ZnS{O}_{4}(a=1)||CuS{O}_{4}(a=1)|Cu(s)$。其中,左边为负极,发生氧化反应,右边为正极,发生还原反应。电极反应分别为:负极:$Zn(s)\rightarrow Zn^{2+}(aq)+2e^{-}$,正极:$Cu^{2+}(aq)+2e^{-}\rightarrow Cu(s)$。
步骤 2:计算电池反应的 ${\Delta }_{1}{G}_{m}$
根据公式 ${\Delta }_{1}{G}_{m}=-nFE$,其中 $n$ 为反应中转移的电子数,$F$ 为法拉第常数,$E$ 为电动势。代入已知条件,$n=2$,$F=96485C/mol$,$E=1.0934V$,计算得 ${\Delta }_{1}{G}_{m}=-211.03 kJ\cdot mol^{-1}$。
步骤 3:计算电池反应的 ${\Delta }_{1}{S}_{m}$
根据公式 ${\Delta }_{1}{S}_{m}=-nF(\dfrac {\partial E}{\partial T})$,代入已知条件,$n=2$,$F=96485C/mol$,$(\dfrac {\partial E}{\partial T})=-4.29\times {10}^{-4}V\cdot {k}^{-1}$,计算得 ${\Delta }_{1}{S}_{m}=-82.80J\cdot {K}^{-1}\cdot {mol}^{-1}$。
步骤 4:计算电池反应的 ${\Delta }_{1}{H}_{m}$
根据公式 ${\Delta }_{1}{H}_{m}={\Delta }_{1}{G}_{m}+T{\Delta }_{1}{S}_{m}$,代入已知条件,${\Delta }_{1}{G}_{m}=-211.03 kJ\cdot mol^{-1}$,${\Delta }_{1}{S}_{m}=-82.80J\cdot {K}^{-1}\cdot {mol}^{-1}$,$T=288K$,计算得 ${\Delta }_{1}{H}_{m}=-234.88kJ\cdot {mol}^{-1}$。
步骤 5:计算电池反应的 QR
根据公式 $QR={\Delta }_{1}{H}_{m}-{\Delta }_{1}{G}_{m}$,代入已知条件,${\Delta }_{1}{H}_{m}=-234.88kJ\cdot {mol}^{-1}$,${\Delta }_{1}{G}_{m}=-211.03 kJ\cdot mol^{-1}$,计算得 $QR=-23.85kJ\cdot {mol}^{-1}$。