题目
1.在等温间歇反应器中进行乙酸乙酯皂化反应:-|||-(H)_(3)COO(C)_(2)(H)_(5)+NaOHarrow C(H)_(3)COONa+(C)_(2)(H)_(5)OH-|||-该反应对乙酸乙酯及氢氧化钠均为一级反应。反应开始时乙酸乙酯及氢氧化钠的浓度均为-|||-.02mol/L, 反应速率常数等于 .6L/(molcdot min) 要求最终转化率达到95%。试问:-|||-(1)当反应器的反应体积为1m^3时,需要多长的反应时间?-|||-(2)若反应器的反应体积为2 m^3,所需的反应时间又是多少?

题目解答
答案
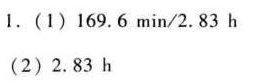
解析
考查要点:本题主要考查二级反应动力学方程的应用,涉及转化率与反应时间的关系。关键在于正确建立积分速率方程并求解。
解题核心思路:
- 确定反应级数:反应对乙酸乙酯和氢氧化钠均为一级,总级数为二级。
- 建立积分速率方程:利用双一级反应的速率方程,结合转化率推导时间表达式。
- 代入已知条件计算:注意单位换算,最终转化率对应的时间与反应体积无关(浓度固定时)。
破题关键点:
- 浓度固定:题目中初始浓度为0.02 mol/L,与反应体积无关,因此两小问时间相同。
- 公式选择:直接应用二级反应积分公式 $t = \frac{1}{k c_0} \left( \frac{1}{1 - \alpha} - 1 \right)$,其中 $\alpha$ 为转化率。
第(1)题
已知条件:
- 初始浓度 $c_0 = 0.02 \, \text{mol/L}$
- 速率常数 $k = 5.6 \, \text{L/(mol·min)}$
- 转化率 $\alpha = 95\% = 0.95$
积分速率方程:
对双一级反应,积分得:
$\frac{1}{c_0 - x} = \frac{1}{c_0} + kt$
其中 $x = \alpha c_0$,代入得:
$t = \frac{1}{k c_0} \left( \frac{1}{1 - \alpha} - 1 \right)$
代入计算:
$t = \frac{1}{5.6 \times 0.02} \left( \frac{1}{1 - 0.95} - 1 \right) = \frac{1}{0.112} \times 19 \approx 169.6 \, \text{min}$
第(2)题
关键分析:
反应时间仅由浓度、速率常数和转化率决定,与反应体积无关。因此,两小问答案相同。