题目
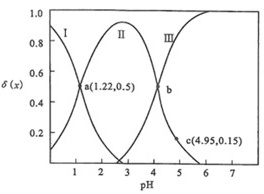
【题文】草酸H2C2O4是二元弱酸。向100 mL 0.40 mol/L H2C2O4溶液中加入1.0 mol/L NaOH溶液调节pH,加水控制溶液体积为200 mL。测得溶液中微粒的δ(x)随 pH变化曲线如图所示,δ(x)=dfrac (c(x))(c({H)_(2)(C)_(2)(O)_(4))+c((H{C)_(2)(O)_(4)}^-)+c((C{)_(2)(O)_(4)}^2-)},x代表微粒H2C2O4、HC2Odfrac (c(x))(c({H)_(2)(C)_(2)(O)_(4))+c((H{C)_(2)(O)_(4)}^-)+c((C{)_(2)(O)_(4)}^2-)}或C2Odfrac (c(x))(c({H)_(2)(C)_(2)(O)_(4))+c((H{C)_(2)(O)_(4)}^-)+c((C{)_(2)(O)_(4)}^2-)}。下列叙述正确的是dfrac (c(x))(c({H)_(2)(C)_(2)(O)_(4))+c((H{C)_(2)(O)_(4)}^-)+c((C{)_(2)(O)_(4)}^2-)} A.曲线Ⅰ是HC2Odfrac (c(x))(c({H)_(2)(C)_(2)(O)_(4))+c((H{C)_(2)(O)_(4)}^-)+c((C{)_(2)(O)_(4)}^2-)}的变化曲线 B.草酸H2C2O4的电离常数K= 1.0×10-1.22 C.在 b点,c(C2Odfrac (c(x))(c({H)_(2)(C)_(2)(O)_(4))+c((H{C)_(2)(O)_(4)}^-)+c((C{)_(2)(O)_(4)}^2-)})+2c(OH-)= c(HC2Odfrac (c(x))(c({H)_(2)(C)_(2)(O)_(4))+c((H{C)_(2)(O)_(4)}^-)+c((C{)_(2)(O)_(4)}^2-)})+c(H+) D.在c点,c(HC2Odfrac (c(x))(c({H)_(2)(C)_(2)(O)_(4))+c((H{C)_(2)(O)_(4)}^-)+c((C{)_(2)(O)_(4)}^2-)})=0.06 mol/L
【题文】草酸H2C2O4是二元弱酸。向100 mL 0.40 mol/L H2C2O4溶液中加入1.0 mol/L NaOH溶液调节pH,加水控制溶液体积为200 mL。测得溶液中微粒的δ(x)随 pH变化曲线如图所示,δ(x)=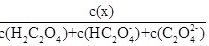 ,x代表微粒H2C2O4、HC2O
,x代表微粒H2C2O4、HC2O 或C2O
或C2O 。下列叙述正确的是
。下列叙述正确的是
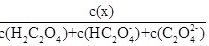 ,x代表微粒H2C2O4、HC2O
,x代表微粒H2C2O4、HC2O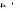 或C2O
或C2O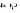 。下列叙述正确的是
。下列叙述正确的是
A.曲线Ⅰ是HC2O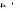 的变化曲线 的变化曲线 |
| B.草酸H2C2O4的电离常数K= 1.0×10-1.22 |
C.在 b点,c(C2O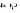 )+2c(OH-)= c(HC2O )+2c(OH-)= c(HC2O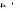 )+c(H+) )+c(H+) |
D.在c点,c(HC2O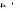 )=0.06 mol/L )=0.06 mol/L |
题目解答
答案
【答案】B
解析
步骤 1:分析曲线Ⅰ和Ⅱ
曲线Ⅰ在pH=1.22时达到最大值0.5,这表明在该pH下,H_2C_2O_4和HC_2O_4^-的浓度相等。因此,曲线Ⅰ代表H_2C_2O_4的变化曲线。曲线Ⅱ在pH=4.95时达到最大值0.15,这表明在该pH下,HC_2O_4^-和C_2O_4^{2-}的浓度相等。因此,曲线Ⅱ代表HC_2O_4^-的变化曲线。
步骤 2:计算草酸H_2C_2O_4的电离常数K
根据曲线Ⅰ在pH=1.22时达到最大值0.5,可以得出H_2C_2O_4的电离常数K=1.0×10^{-1.22}≈1.0×10^{-1.22}≈6.0×10^{-2}。
步骤 3:分析b点的电荷平衡
在b点,溶液中存在H_2C_2O_4、HC_2O_4^-和C_2O_4^{2-},根据电荷平衡,有c(C_2O_4^{2-})+2c(OH^-)=c(HC_2O_4^-)+c(H^+)。
步骤 4:计算c点的HC_2O_4^-浓度
在c点,溶液中存在H_2C_2O_4、HC_2O_4^-和C_2O_4^{2-},根据δ(x)=$\dfrac {c(x)}{c({H}_{2}{C}_{2}{O}_{4})+c({H{C}_{2}{O}_{4}}^{2})+c({{C}_{2}{O}_{4}}^{2-})}$,可以得出c(HC_2O_4^-)=0.06 mol/L。
曲线Ⅰ在pH=1.22时达到最大值0.5,这表明在该pH下,H_2C_2O_4和HC_2O_4^-的浓度相等。因此,曲线Ⅰ代表H_2C_2O_4的变化曲线。曲线Ⅱ在pH=4.95时达到最大值0.15,这表明在该pH下,HC_2O_4^-和C_2O_4^{2-}的浓度相等。因此,曲线Ⅱ代表HC_2O_4^-的变化曲线。
步骤 2:计算草酸H_2C_2O_4的电离常数K
根据曲线Ⅰ在pH=1.22时达到最大值0.5,可以得出H_2C_2O_4的电离常数K=1.0×10^{-1.22}≈1.0×10^{-1.22}≈6.0×10^{-2}。
步骤 3:分析b点的电荷平衡
在b点,溶液中存在H_2C_2O_4、HC_2O_4^-和C_2O_4^{2-},根据电荷平衡,有c(C_2O_4^{2-})+2c(OH^-)=c(HC_2O_4^-)+c(H^+)。
步骤 4:计算c点的HC_2O_4^-浓度
在c点,溶液中存在H_2C_2O_4、HC_2O_4^-和C_2O_4^{2-},根据δ(x)=$\dfrac {c(x)}{c({H}_{2}{C}_{2}{O}_{4})+c({H{C}_{2}{O}_{4}}^{2})+c({{C}_{2}{O}_{4}}^{2-})}$,可以得出c(HC_2O_4^-)=0.06 mol/L。