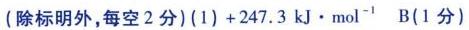题目
③(H)_(4)(g)leftharpoons C(s)+2(H)_(2)(g) Delta (H)_(3)=+74.9kJcdot (mol)^-1-|||-④(g)+(H)_(2)(g)leftharpoons (H)_(2)O(g)+C(s) Delta H=-131.3kJcdot (mol)^-1-|||-(1) Delta (H)_(1)= __ ,反应① __ 正向自发进行(填标号)。-|||-A.低温下能 B.高温下能-|||-C.任何温度下都能 D.任何温度下都不能-|||-(2)反应体系总压强分别为5.00MPa、1.00 MPa和0.50 MPa时,CH4平衡转化率随反应温度变化如图1-|||-所示,则代表反应体系总压强为5.00MPa的曲线是 __ (填"I""Ⅱ"或"Ⅲ"),判断依据是-|||-__-|||-100- 会 会-|||-90 △-|||-80- A A △-|||-Ⅱ-|||-70- △-|||-△ △ Ⅲ-|||-个-|||-△-|||-60-|||-△-|||-50-|||-600 700 800 900 1000 1100 1200-|||-反应温度/℃-|||-图1-|||-(3)当反应体系总压强为0.1MPa时,平衡时部分组分的物质的量随反应温度变化如图2所示。随反应-|||-温度的升高,CO2的物质的量先增加后减少,主要原因是 __-|||--o-CO2(g)-|||-1.5- -□-C(s)-|||-岳-|||-1.0--|||-0.5 b-|||-0.0. -D-|||-0 200 400 600 800 10001200-|||-反应温度/℃-|||-图2-|||-(4)恒温恒压条件下,向容器中通入1 mol CH4和1molCO2,达到平衡时CH4的转化率为80%,CO2的转-|||-化率为50%,碳单质的物质的量为0.8 mol,CO的物质的量为 __ mol,反应①用摩尔分数表示的-|||-平衡常数 K= __ _(结果保留两位小数)。上述平衡时 +dfrac ({c)^2((H)_(2))}(c(C{H)_(4))}=a ,向体系中通入He气,重新达-|||-到平衡时 +dfrac ({c)^2((H)_(2))}(c(C{H)_(4))}=b ,则a __ _b(填">""<"或"=")。(已知反应 (g)+bB(g)leftharpoons c(C)_((g))+-|||-dD(g)的 =dfrac ({{x)_(c)}^ccdot ({x)_(b)}^d}({{x)_(A)}^acdot ({x)_(b)}^b} 物质i的摩尔分数 _(1)=dfrac ({n)_(1)}({n)_(总)} )
题目解答
答案