(1)(2)(5) (8)是物质的物理性质;(3)(4)(6)(7)是物质的化学性质。P12对蜡烛及其燃烧的探究活动进行观察和描述的参考资料:点燃前:蜡烛呈圆柱状,直径约2 cm,由半透明的白色固体制成,具有轻微气味,质地较柔软,能用小刀切割,指甲也能划出刻痕。蜡烛的中心有一根烛芯,从底部一直伸延到顶部,并约有1cm露出顶部。烛芯由多股细线拧合而成。从蜡烛上切下一块石蜡,把它放入水中,它不溶于水,并能浮在水面上,说明石蜡的密度比水的小。点燃时:当燃烧着的火柴接近烛芯时,约2s~3s即可点燃蜡烛。点燃的蜡烛能够持续燃烧,燃烧时没有声音,并在燃烧的过程中缓慢地变短。蜡烛火焰由于气流而闪烁摇晃,并有黑烟产生,在无空气流动的情况下,火焰可以长时间地保持轻微的闪烁。在距离蜡烛火焰约2cm的地方,蜡烛是温热的,并很柔软,可以用手任滤、蒸馏。2、B3、自然界中的水始终处于开放的环境中,其中必然含有可溶性和不溶性的杂质。4、静置沉淀,吸附沉淀,过滤,蒸馏等。5、略P64习题1.农业用水70.43%,工业用水20.14%,生活用水9.43%。2、1650mL3、4.32L。滴漏浪费巨大,应及时修理,并在平时应注意定期检修。4、略5、略P72习题1.(1)B(2)B(3)B2.一种氧原子是由8个质子、8个中子和8个核外电子构成的。因为中子不带电,质子和电子数量相等,所带电荷相反,所以,整个氧原子不显电性。3.N14.01,Cl4、.45,Na22.99,Fe55.854.钠最多,铝最少。因钠的相对原子质量最小,铝最大。P73讨论:反应物跟生成物相比较,分子都发生了变化,元素没有发生变化。P74活动与探究:1略。2、地壳中含量最多的元素是氧,其次是硅;地壳中含量最多的金属元素是铝,其次是铁。P76活动与探究:1、①6号元素为碳,符号C,核外电子数6,相对原子质量12,为非金属元素(以下顺序相同)。②7号:氮,N,7,14,非金属。③12号:镁,Mg,12,24,金属。④14号:硅,Si,14,28,非金属。⑤16号:硫,S,16,32,非金属。⑥18号:氩,Ar,19,39,95,稀有气体。⑦20号:钙,Ca,20,40,金属。⑧29号:铜,Cu,29,63.5,金属。⑨47号:银,Ag,47,108,金属。2、除第一周期外,每周期开头为金属元素,靠近尾部是非金属元素,结尾是稀有气体元素。这说明元素之间随着原子序数的递增,元素的性质出现了周期性的变化。“元素周期表”的名称与这一规律有关。P77习题1.(1)A(2)C2、3参考课本P75表4-34.Cu,Zn,Ag,Cl,CaP80习题1.(1) 17 3 8 7得到(2)少于 失去(3) 8 2惰性(4)正 阳 负 阴 阳 阴 不显2.CP81讨论:①H表示氢元素或1个氢原子。②2H表示2个氢原子。③H2表示氢气这种物质或1个氢分子或每个氢分子由两个氢原子组成。P83活动与探究:2、记忆歌诀:正一氢钠钾和银,氟氯溴碘负一寻;二价氧镁钙钡锌,三铝四硅五价磷,四二是碳三二铁,一二铜汞一三金,硫逢双价二四六,锰为二四六和七,单质规定为零价。P84活动与探究:1、在SO2里,O为-2价,根据化合价为0的原则,S肯定为正价。设S的化合价为+x。+x+(-2)×2=0,求得x=+4,所以二氧化硫里硫的化合价为+4价。2(2)-|||-B (5)H 2-|||-4CO2(2)3K (3)8N0 2(4)7N Ca+2,Ag +1, W+6-|||-3. S+4 , +1, (4) -3-|||-(1) +2 (2) +4 (3) +5 CO. N2O5. MgO. CaO-|||-4.-|||-6.(2)-|||-B (5)H 2-|||-4CO2(2)3K (3)8N0 2(4)7N Ca+2,Ag +1, W+6-|||-3. S+4 , +1, (4) -3-|||-(1) +2 (2) +4 (3) +5 CO. N2O5. MgO. CaO-|||-4.-|||-6.、NaBr、CaO、Al2O3、NO23、二氧化锰、氧化铜、三氧化硫、碘化钾、氯化镁P91表格:方案一现象:在白磷燃烧这个实验中看到白磷燃烧产生大量白烟,生成一种白色固体,气球先膨胀后缩小,反应前后物质的质量总和没有发生改变。方案二现象:铁钉表面有一层红色的物质析出;溶液的颜色由蓝色变为浅绿色;用天平称量,发现反应前后物质的质量总和没有发生改变。分析:在化学反应中,只是由于发生了原子间的重新组合,才使反应物变成生成物,但在这一变化中,原子的种类和个数并没有发生变化,原子的质量也没有发生变化,所以, 反应前和反应后各物质的质量总和必然相等。结论:参加化学反应的各物质的质量总和,等于反应后生成的各物质的质量总和。P92[实验5-1]天平不平衡,反应后小烧杯中的物质比反应前轻了。[实验5-2]反应后所得的产物比镁条的质量重。P93讨论1、实验5-1生成物二氧化碳是气体,挥发到了空气中,所以会出现反应后小烧杯中的物质比反应前轻这种情况;在镁带燃烧这个实验中,因为反应物有空气中的氧气参加,而我们反应前所称量的仅仅是镁带的质量,所以会出现生成物的质量大于反应物的质量这种情况。2、天平平衡3、在反应C+O2______CO2中,反应前后原子种类没有改变、原子数目没有增减、碳和氧原子的质量也没有改变,故这个反应必定符合质量守恒定律。P94讨论参考P95“学完本课你应该知道”中的3。P95习题1、(1)B(2)D(3)D2、不对,所有的化学反应都遵守质量守恒定律。蜡烛燃烧后质量变小了是因为燃烧时生成的CO2和水蒸气逸到空气中去了。3.(1)镁带在空气里燃烧,是镁和氧气发生了化学反应。根据质量守恒定律,反应后生成物的质量,一定等于参加反应的镁带和氧气的质量总和,所以生成物的质量比镁带大。(2)由于纸中的碳与氧气反应生成二氧化碳气体后逸走,故灰烬的质量比纸的质量小。(3)高锰酸钾受热分解后,生成锰酸钾(固体)、二氧化锰(固体)和氧气。按照质量守恒定律,反应物高锰酸钾的质量应当等于生成物锰酸钾、二氧化锰和氧气的质量之和,而氧气逸走了,所剩余固体的质量必然比原高锰酸钾的质量要小。(4)1)正确。 (2)错误。细铁丝在氧气里燃烧,反应物是铁和氧气,生成物是四氧化三铁,这个反应同样遵守质量守恒定律。P99习题1、(1)2H2O______2H2↑+O2↑(2)2Mg+O2______2MgO2、124 160 2843、2KClO3△MnO22KCl+3O2↑4.(1)未配平, 没有注明反应条件“△”。(2)“↑”符号使用不当。5.C2H4P101课堂练习:解:设需要氯气的质量为x,生成氯化氢气体的质量为y。H2+Cl2点 燃2HCl27173100g x2/100g=71/xx=3550g2/100g=73/yy=3650 g答: 需要氯气3550g, 生成氯化氢气体3650g。P101习题1.(1)D(2)B(3)D2.(1)C2H4+3O22CO2+2H2O(2)2NaOH+CuS4=OCu(OH)2↓+Na2SO4(3)Fe2O3+3H22Fe+3H2O(4)Fe2O3+3CO2Fe+3CO23.(1)CH4+2O2CO2+2H2O(2)Zn+H2SO4(稀)=ZnSO4+H2↑4.3.8g。5.需消耗水112.5kg,可得到氢气12.5kg。6.可制得氢气0.11g,氯化锌7.7g。P105[实验6-1]现象:红色液体变为无色。P105讨论:物质的性质决定其用途。如石墨的物理性质为质软、有滑腻感、能导电等,所以可用于制铅笔芯、润滑剂和电极等。P107化学方程式:C+O2______CO2P108家庭小实验:1、灯泡发亮,这个实验说明石墨能导电。2、蜡烛不充分燃烧可产生炭黑,说明蜡烛的成分中含有碳元素。P109习题:1.碳2(1)金刚石可用来裁玻璃、作刀具等;(2)石墨可作电极、电刷等;(3)活性炭可用于防毒面具及制糖工业;(4)焦炭可从铁的氧化物矿石中还原出铁;(5)可用墨书写或绘制字画;(6)可用煤(主要成分是碳)燃烧放出的热来取暖、发电。3.因为石墨具有导电性。4.木头烤焦以后就变成了木炭,木炭与空气、水分接触不容易发生反应,可以保存较长的时间。.
(1)(2)(5) (8)是物质的物理性质;(3)(4)(6)(7)是物质的化学性质。
P12对蜡烛及其燃烧的探究活动进行观察和描述的参考资料:
点燃前:蜡烛呈圆柱状,直径约2 cm,由半透明的白色固体制成,具有轻微气味,质地较柔软,能用小刀切
割,指甲也能划出刻痕。蜡烛的中心有一根烛芯,从底部一直伸延到顶部,并约有1cm露出顶部。烛芯由多
股细线拧合而成。从蜡烛上切下一块石蜡,把它放入水中,它不溶于水,并能浮在水面上,说明石蜡的密度比
水的小。
点燃时:当燃烧着的火柴接近烛芯时,约2s~3s即可点燃蜡烛。点燃的蜡烛能够持续燃烧,燃烧时没有声
音,并在燃烧的过程中缓慢地变短。蜡烛火焰由于气流而闪烁摇晃,并有黑烟产生,在无空气流动的情况下,
火焰可以长时间地保持轻微的闪烁。在距离蜡烛火焰约2cm的地方,蜡烛是温热的,并很柔软,可以用手任
滤、蒸馏。
2、B3、自然界中的水始终处于开放的环境中,其中必然含有可溶性和不溶性的杂质。
4、静置沉淀,吸附沉淀,过滤,蒸馏等。5、略
P64习题1.农业用水70.43%,工业用水20.14%,生活用水9.43%。2、1650mL
3、4.32L。滴漏浪费巨大,应及时修理,并在平时应注意定期检修。4、略5、略
P72习题1.(1)B(2)B(3)B2.一种氧原子是由8个质子、8个中子和8个核外电子构成的。因
为中子不带电,质子和电子数量相等,所带电荷相反,所以,整个氧原子不显电性。3.N14.01,Cl
4、.45,Na22.99,Fe55.85
4.钠最多,铝最少。因钠的相对原子质量最小,铝最大。
P73讨论:反应物跟生成物相比较,分子都发生了变化,元素没有发生变化。
P74活动与探究:1略。2、地壳中含量最多的元素是氧,其次是硅;地壳中含量最多的金属元素是铝,其次
是铁。
P76活动与探究:1、①6号元素为碳,符号C,核外电子数6,相对原子质量12,为非金属元素(以下顺序相
同)。②7号:氮,N,7,14,非金属。③12号:镁,Mg,12,24,金属。④14号:硅,Si,14,28,非金属。
⑤16号:硫,S,16,32,非金属。⑥18号:氩,Ar,19,39,95,稀有气体。⑦20号:钙,Ca,20,40,
金属。⑧29号:铜,Cu,29,63.5,金属。⑨47号:银,Ag,47,108,金属。
2、除第一周期外,每周期开头为金属元素,靠近尾部是非金属元素,结尾是稀有气体元素。
这说明元素之间随着原子序数的递增,元素的性质出现了周期性的变化。“元素周期表”的名称与这一规律有关。
P77习题1.(1)A(2)C2、3参考课本P75表4-34.Cu,Zn,Ag,Cl,Ca
P80习题1.(1) 17 3 8 7得到(2)少于 失去(3) 8 2惰性(4)正 阳 负 阴 阳 阴 不显2.C
P81讨论:①H表示氢元素或1个氢原子。②2H表示2个氢原子。
③H2表示氢气这种物质或1个氢分子或每个氢分子由两个氢原子组成。
P83活动与探究:2、记忆歌诀:正一氢钠钾和银,氟氯溴碘负一寻;二价氧镁钙钡锌,三铝四硅五价磷,
四二是碳三二铁,一二铜汞一三金,硫逢双价二四六,锰为二四六和七,单质规定为零价。
P84活动与探究:1、在SO2里,O为-2价,根据化合价为0的原则,S肯定为正价。设S的化合价为+x。
+x+(-2)×2=0,求得x=+4,所以二氧化硫里硫的化合价为+4价。
2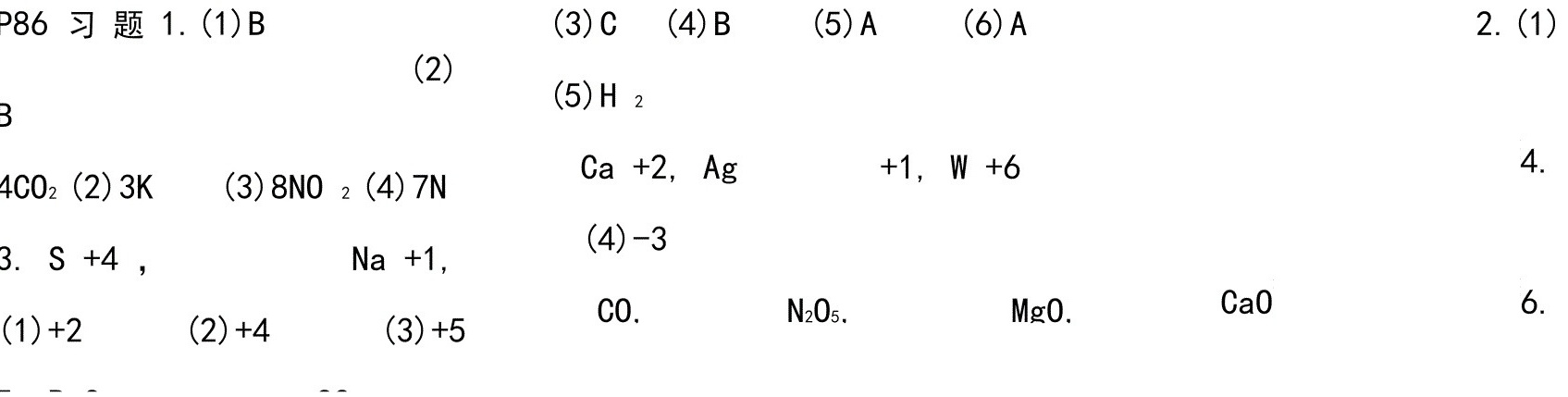
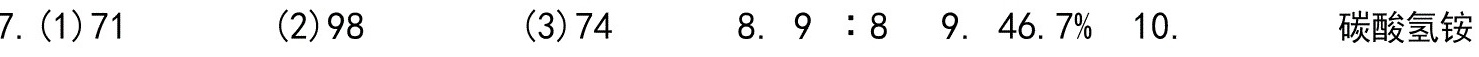 、NaBr、CaO、Al2O3、NO23、二氧化锰、氧化铜、三氧化硫、碘化钾、氯化镁
、NaBr、CaO、Al2O3、NO23、二氧化锰、氧化铜、三氧化硫、碘化钾、氯化镁
P91表格:方案一现象:在白磷燃烧这个实验中看到白磷燃烧产生大量白烟,生成一种白色固体,气球先膨胀
后缩小,反应前后物质的质量总和没有发生改变。
方案二现象:铁钉表面有一层红色的物质析出;溶液的颜色由蓝色变为浅绿色;用天平称量,发现反应前后物质的质量
总和没有发生改变。
分析:在化学反应中,只是由于发生了原子间的重新组合,才使反应物变成生成物,但在这一变化中,原子的
种类和个数并没有发生变化,原子的质量也没有发生变化,所以, 反应前和反应后各物质的质量总和必然相等。
结论:参加化学反应的各物质的质量总和,等于反应后生成的各物质的质量总和。
P92[实验5-1]天平不平衡,反应后小烧杯中的物质比反应前轻了。[实验5-2]反应后所得的产物比镁条的质量
重。
P93讨论1、实验5-1生成物二氧化碳是气体,挥发到了空气中,所以会出现反应后小烧杯中的物质比反应前
轻这种情况;
在镁带燃烧这个实验中,因为反应物有空气中的氧气参加,而我们反应前所称量的仅仅是镁带的质量,所以会
出现生成物的质量大于反应物的质量这种情况。2、天平平衡3、在反应C+O2______CO2中,
反应前后原子种类没有改变、原子数目没有增减、碳和氧原子的质量也没有改变,故这个反应必定符合质量守
恒定律。
P94讨论参考P95“学完本课你应该知道”中的3。
P95习题1、(1)B(2)D(3)D
2、不对,所有的化学反应都遵守质量守恒定律。蜡烛燃烧后质量变小了是因为燃烧时生成的CO2和水蒸气逸
到空气中去了。
3.(1)镁带在空气里燃烧,是镁和氧气发生了化学反应。根据质量守恒定律,反应后生成物的质量,一定等于
参加反应的镁带和氧气的质量总和,所以生成物的质量比镁带大。
(2)由于纸中的碳与氧气反应生成二氧化碳气体后逸走,故灰烬的质量比纸的质量小。
(3)高锰酸钾受热分解后,生成锰酸钾(固体)、二氧化锰(固体)和氧气。按照质量守恒定律,反应物高锰酸钾
的质量应当等于生成物锰酸钾、二氧化锰和氧气的质量之和,而氧气逸走了,所剩余固体的质量必然比原高锰
酸钾的质量要小。
(4)1)正确。 (2)错误。细铁丝在氧气里燃烧,反应物是铁和氧气,生成物是四氧化三铁,这个反应同样遵
守质量守恒定律。
P99习题1、(1)2H2O______2H2↑+O2↑(2)2Mg+O2______2MgO2、124 160 284
3、2KClO3△MnO22KCl+3O2↑4.(1)未配平, 没有注明反应条件“△”。(2)“↑”符号使用不当。5.
C2H4
P101课堂练习:解:设需要氯气的质量为x,生成氯化氢气体的质量为y。
H2+Cl2点 燃2HCl
27173
100g x
2/100g=71/xx=3550g2/100g=73/yy=3650 g答: 需要氯气3550g, 生成氯化氢气体3650
g。
P101习题1.(1)D(2)B(3)D
2.(1)C2H4+3O22CO2+2H2O(2)2NaOH+CuS4=OCu(OH)2↓+Na2SO4(3)Fe2O3+3H22Fe+3H2O(4)
Fe2O3+3CO2Fe+3CO2
3.(1)CH4+2O2CO2+2H2O(2)Zn+H2SO4(稀)=ZnSO4+H2↑
4.3.8g。5.需消耗水112.5kg,可得到氢气12.5kg。6.可制得氢气0.11g,氯化锌7.7g。
P105[实验6-1]现象:红色液体变为无色。
P105讨论:物质的性质决定其用途。如石墨的物理性质为质软、有滑腻感、能导电等,所以可用于制铅笔芯、
润滑剂和电极等。
P107化学方程式:C+O2______CO2
P108家庭小实验:1、灯泡发亮,这个实验说明石墨能导电。2、蜡烛不充分燃烧可产生炭黑,说明蜡烛的
成分中含有碳元素。
P109习题:1.碳2(1)金刚石可用来裁玻璃、作刀具等;(2)石墨可作电极、电刷等;(3)活性炭可用于防
毒面具及制糖工业;
(4)焦炭可从铁的氧化物矿石中还原出铁;(5)可用墨书写或绘制字画;(6)可用煤(主要成分是碳)燃烧放出的
热来取暖、发电。
3.因为石墨具有导电性。4.木头烤焦以后就变成了木炭,木炭与空气、水分接触不容易发生反应,可以
保存较长的时间。
.题目解答
答案
点燃通电 点燃 点燃
.