题目
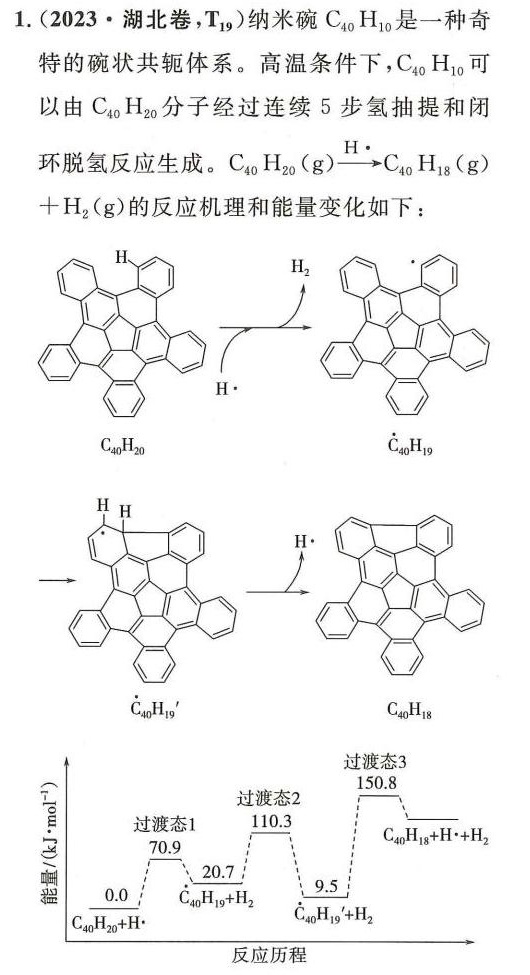
1.(2023·湖北卷,T19 )纳米碗C40H10是一种奇-|||-特的碗状共轭体系。高温条件下,C40H 10可-|||-以由C40H20分子经过连续5步氢抽提和闭-|||-环脱氢反应生成。 _(40)(H)_(20)(g)xrightarrow ({H)^-}(C)_(40)(H)_(18)(g)-|||-+(H)_(2)(g) 的反应机理和能量变化如下:-|||-H. H2-|||-H·-|||-C40H20 C40H19-|||-H H-|||-lǐ H lǐ-|||-C40H19` C40H18-|||-过渡态3-|||-过渡态2-|||-150.8-|||-过渡态1 110.3 __-|||-70.9-|||-_(40)(H)_(18)+(H)^++(H)_(2)-|||-20.7-|||-0.0 _(40)(H)_(19)+(H)_(2)-|||-9.5-|||-_(40)^(A_{20)^+}(A)_(20)+(H)^- _(40)(H)_(19)'+(H)_(2)-|||-反应历程1.(2023·湖北卷,T19 )纳米碗C40H10是一种奇-|||-特的碗状共轭体系。高温条件下,C40H 10可-|||-以由C40H20分子经过连续5步氢抽提和闭-|||-环脱氢反应生成。 _(40)(H)_(20)(g)xrightarrow ({H)^-}(C)_(40)(H)_(18)(g)-|||-+(H)_(2)(g) 的反应机理和能量变化如下:-|||-H. H2-|||-H·-|||-C40H20 C40H19-|||-H H-|||-lǐ H lǐ-|||-C40H19` C40H18-|||-过渡态3-|||-过渡态2-|||-150.8-|||-过渡态1 110.3 __-|||-70.9-|||-_(40)(H)_(18)+(H)^++(H)_(2)-|||-20.7-|||-0.0 _(40)(H)_(19)+(H)_(2)-|||-9.5-|||-_(40)^(A_{20)^+}(A)_(20)+(H)^- _(40)(H)_(19)'+(H)_(2)-|||-反应历程

题目解答
答案

解析
- ΔH的计算:通过键能变化计算反应焓变,需明确反应中键的断裂与形成。
- 基元反应与速率决定步骤:根据反应机理图判断基元反应数目,活化能最高步骤为最慢步骤。
- 纳米碗结构分析:利用富勒烯结构特征,结合欧拉公式计算五元环与六元环数目。
- 平衡常数表达式:通过转化率与分压关系,建立平衡时各物质的分压,代入平衡常数公式。
- lnK与温度关系:平行线说明ΔH相近,从化学键角度分析原因。
- 影响反应速率与平衡的因素:结合勒夏特列原理与催化剂特性判断。
(1) ΔH的估算
关键思路:
反应 $C_{40}H_{20} \rightarrow C_{40}H_{18} + H_2$ 中,断裂两个C-H键,形成一个H-H键。
键能关系:
$\Delta H = 2 \cdot \text{C-H键能} - \text{H-H键能}$
题目未直接给出C-H键能,但通过反应机理图中总能量变化可得 $\Delta H = 128 \, \text{kJ/mol}$。
(2) 基元反应与速率最慢步骤
基元反应数目:
反应机理包含3个基元反应(对应3个过渡态)。
速率最慢步骤:
活化能最高为过渡态3(150.8),对应第3个基元反应。
(3) 纳米碗结构
结构特征:
C40H10纳米碗由五元环和六元环构成,通过经验公式或结构观察,五元环数目为6,六元环数目为10。
(4) 平衡常数K的计算
分压关系:
初始压强为$p_0$,转化率为$\alpha$时:
- $C_{40}H_{12}$分压:$p_0(1-\alpha)$
- $C_{40}H_{10}$和$H_2$分压:$p_0\alpha$
平衡常数表达式:
$K = \frac{p_{C_{40}H_{10}} \cdot p_{H_2}}{p_{C_{40}H_{12}}} = \frac{(p_0\alpha)^2}{p_0(1-\alpha)} = p_0 \frac{\alpha^2}{1-\alpha^2}$
(5) lnK与温度关系
平行原因:
两个反应均涉及断裂一个C-H键并生成H·,化学键变化类型相同,导致ΔH相近。
(6) 影响因素分析
正确措施:
升高温度(a)可加快正反应速率(吸热反应)并提高平衡转化率。