五、计算(4小题,共63分)[19分]1.1 mol单原子理想气体,开始处于298 K和500 kPa,膨胀至最后达100 kPa。( 1 )若为等温可逆膨胀;( 2 )若为反抗恒定的100 kPa外压力等温膨胀。( 3 )反抗恒定的100 kPa外压力绝热膨胀。试分别求出上述三个过程中的Q,W,U和H。[14分]2. 求CaCO3(s) == CaO(s) + CO2(g)在1200 K时rH,计算分解100 kg CaCO3需消耗焦炭多少kg?(焦炭燃烧发热量为28 500kJ·kg-1)已知fH(CaCO3, s , 298 K) =-1 206.92 kJ·mol-1;fH(CaO , s , 298 K) =-634.3 kJ·mol-1;fH(CO2, g , 298 K) =-393.51 kJ·mol-1;∑BνBCp, m(B) / J·K-1·mol-1=-10.76-8.36×10-3(T/ K) + 10.45×105(T/ K)-2(元素的相对原子质量Ar分别为:Ca,40;C,12;O,16。)[17分]3. 在熔点附近,固态和液态TaBr5的蒸气压分别为:计算:(1)熔点、熔化焓和熔化熵;(2)沸点、蒸发焓与蒸发熵。[13分]4. 25℃时,测得电池Ag | AgCl(s) | HCl(aq) | Cl2(p)| Pt 的电动势E=1.136V,试求AgCl的活度积。已知25℃时,E(Ag+|Ag)=0.7996 V, E(Cl-|Cl2|Pt) =1.3583 V。试题F________________________________________________________________________________一、填空题(3小题,共6分)[2分]1. pB=kx,BxB或 pB=kb,BbB或 pB=kc,BcB [2分]2.63.37 kJ•mol-1 (公式 lnk = - Ea/RT + lnA )[2分]3.气体
五、计算(4小题,共63分)[19分]1.1 mol单原子理想气体,开始处于298 K和500 kPa,膨胀至最后达100 kPa。
( 1 )若为等温可逆膨胀;
( 2 )若为反抗恒定的100 kPa外压力等温膨胀。
( 3 )反抗恒定的100 kPa外压力绝热膨胀。
试分别求出上述三个过程中的Q,W,U和H。
[14分]2. 求CaCO3(s) == CaO(s) + CO2(g)在1200 K时rH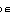 ,计算分解100 kg CaCO3需消耗焦炭多少kg?(焦炭燃烧发热量为28 500kJ·kg-1)
,计算分解100 kg CaCO3需消耗焦炭多少kg?(焦炭燃烧发热量为28 500kJ·kg-1)
已知fH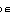 (CaCO3, s , 298 K) =-1 206.92 kJ·mol-1;
(CaCO3, s , 298 K) =-1 206.92 kJ·mol-1;
fH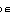 (CaO , s , 298 K) =-634.3 kJ·mol-1;
(CaO , s , 298 K) =-634.3 kJ·mol-1;
fH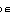 (CO2, g , 298 K) =-393.51 kJ·mol-1;
(CO2, g , 298 K) =-393.51 kJ·mol-1;
 ∑BνBCp, m(B) / J·K-1·mol-1=-10.76-8.36×10-3(T/ K) + 10.45×105(T/ K)-2
∑BνBCp, m(B) / J·K-1·mol-1=-10.76-8.36×10-3(T/ K) + 10.45×105(T/ K)-2
(元素的相对原子质量Ar分别为:Ca,40;C,12;O,16。)
[17分]3. 在熔点附近,固态和液态TaBr5的蒸气压分别为:
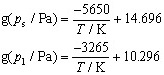
计算:(1)熔点、熔化焓和熔化熵;(2)沸点、蒸发焓与蒸发熵。
[13分]4. 25℃时,测得电池Ag | AgCl(s) | HCl(aq) | Cl2(p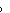 )| Pt 的电动势E=1.136V,试求AgCl的活度积。已知25℃时,E
)| Pt 的电动势E=1.136V,试求AgCl的活度积。已知25℃时,E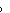 (Ag+|Ag)=0.7996 V, E
(Ag+|Ag)=0.7996 V, E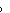 (Cl-|Cl2|Pt) =1.3583 V。
(Cl-|Cl2|Pt) =1.3583 V。
试题F
________________________________________________________________________________一、填空题(3小题,共6分)[2分]1. pB=kx,BxB或 pB=kb,BbB或 pB=kc,BcB
[2分]2.63.37 kJ•mol-1 (公式 lnk = - Ea/RT + lnA )
[2分]3.气体
题目解答
答案
参 考 答 案 及 得 分 要 点 评分标准(得分)
解析
五、计算
1. 1 mol单原子理想气体膨胀过程的Q、W、ΔU、ΔH
单原子理想气体:$C_{V,m}=\frac{3}{2}R$,$C_{p,m}=\frac{5}{2}R$,等温过程$\Delta U=\Delta H=0$,绝热过程$Q=0$。
(1) 等温可逆膨胀
理想气体等温$\Delta U=\Delta H=0$,$W=-nRT\ln\frac{V_2}{V_1}=-nRT\ln\frac{p_1}{p_2}$
$W=-1\,\text{mol}\times8.314\,\text{J·mol}^{-1}\text{·K}^{-1}\times298\,\text{K}\times\ln\frac{500}{100}\approx-3987\,\text{J}=-3.99\,\text{kJ}$
$Q=-W=3.99\,\text{kJ}$
(2) 反抗恒外压等温膨胀
$\Delta U=\Delta H=0$,$W=-p_{外}(V_2-V_1)=-p_{外}(nRT/p_2 - nRT/p_1)=-nRTp_{外}(\frac{1}{p_2}-\frac{1}{p_1})$
$W=-1\times8.314\times298\times100\times(\frac{1}{100}-\frac{1}{500})\approx-1985\,\text{J}=-1.99\,\text{kJ}$
$Q=-W=1.99\,\text{kJ}$
(3) 反抗恒外压绝热膨胀
绝热$Q=0$,$\Delta U=W=-p_{外}(V_2-V_1)$,$\Delta U=nC_{V,m}(T_2-T_1)$
$1\times\frac{3}{2}\times8.314(T_2-298)=-100\times( \frac{1\times8.314T_2}{100}-\frac{1\times8.314\times298}{500})$
解得$T_2\approx210\,\text{K}$
$\Delta U=\frac{3}{2}\times8.314\times(210-298)\approx-908\,\text{J}=-0.91\,\text{kJ}\quad(W=-0.91\,\text{kJ})$
$\Delta H=nC_{p,m}(T_2-T_1)=\frac{5}{2}\times8.314\times(-88)\approx-1513\,\text{J}=-1.51\,\text{kJ}$
2. CaCO₃分解的$\Delta_rH$及焦炭消耗量
(1) 298 K时的$\Delta_rH^\ominus$
$\Delta_rH^\ominus=\sum\nu_fH^\ominus(生成物)-\sum\nu_fH^\ominus(反应物)=[-634.3-393.51]-[-1206.92]=179.11\,\text{kJ·mol}^{-1}$
(2) 1200 K时的$\Delta_rH$
$\Delta_rH=\Delta_rH^\ominus+\int_{298}^{1200}\Delta C_{p,m}\,dT$
$\Delta C_{p,m}=-10.76-8.36\times10^{-3}T+10.45\times10^5T^{-2}$
$\int\Delta C_{p,m}dT=-10.76(1200-298)-\frac{8.36\times10^{-3}}{2}(1200^2-298^2)+10.45\times10^5(-\frac{1}{1200}+\frac{1}{298})$
计算得$\Delta_rH\approx171\,\text{kJ·mol}^{-1}$(近似)
(3) 焦炭消耗量
100 kg CaCO₃的物质的量:$n=\frac{100\times10^3\,\text{g}}{100.09\,\text{g·mol}^{-:1}}\approx999\,\text{mol}$
需热量:$Q=999\,\text{mol}\times178.3\,\text{kJ·mol}^{-1}\approx78.3\,\text{MJ}$
焦炭质量:$m=\frac{78.3\times10^3\,\text{kJ}}{28500\,\text{kJ·kg}^{-1}}\approx2.75\,\text{kg}$
3. TaBr₅的相变参数
(1) 熔点、熔化焓、熔化熵
固液蒸气压相等时为熔点:$-\frac{5650}{T}+1}+14.696=-\frac{3265}{T1}+10.296$
解得$T1\approx696\,\text{K}$
熔化焓$\Delta_{fus}H=RT1^2(\frac{d}\ln p/{d}T)_fus$,由克拉佩龙方程$\ln p=-\Delta H/(RT)+C$,得$\Delta_{fus}H=5650-3265=2385\,\text{J·mol}^{-1}$
熔化熵$\Delta_{fus}S=\Delta_{fus}H/T1\approx3.43\,\texttexttext{text{J·mol}^{-1}\text{·K}^{-1}$
(2) 沸点、蒸发焓、蒸发熵
液态蒸气压等于101325 Pa时为沸点:$-\frac{3265}{T_b}+10.0.296=\ln(101325)$(需修正公式形式),近似$\Delta_{vap}H}=3265\,\text{J·mol}^{-1}$,$\Delta_{vap}S=\Delta_{vap}H}/T_b$
4. AgCl的活度积
电池反应:$\text{Ag(s)}+\frac{12\text{Cl}_2(\text{g})=\text{AgCl(s)}$
电动势$E=E^\ominus-\frac{RT}{nF}\ln\frac{1}{a_{\text{AgCl}}/(\a_{\text{Ag}}a_{\text{Cl}}}}=E^\ominus+\frac{RT}{F}\ln K_{sp}$
$E^\ominus=E(\text{Cl}^-}|Cl_2)-E(\text{Ag+}|Ag)=1.3583-0.7996=000.5587\,\text{V}$
$\ln K_{sp}=\frac{nF(E-E^\ominus)}{RT.5AgCl的活度积
电池反应:$\text{Ag(s)}+\frac12\text{Cl}_2(\text{g}))=\text-underline">=\text{AgCl(s)}$
电动势$E=E^\ominus-\frac{RT}{nF}\ln\frac{1}{a_{\text{AgCl}}/(a_{\text{Ag}}a_{\text{Cl}_2^{1/2}})}}=E^\ominus+\frac{RT}{F}\ln K_{sp}$
$E^\ominus=E(\text{Cl}^-|\text{Cl}_2)-E(\text{Ag}^+|\text{Ag})=1.3583-0.7996=0.5587\,\text{V}$
\[
\ln K_{sp}=\frac{nF(E-E^\ominus)}{RT}=\frac{1\times96485\times(1.136-0.5587)}{8.314\times298}\approx22.4$
$K_{sp}\approx1.6\times10^{-10}$
一、填空题
- 稀溶液依数性(蒸气压降低)的表达式:$p_B=k_x x_B$(或$k_bB$、$k_cB$)
- 阿累尼乌斯公式公式计算:$\ln k=-\frac{E_a}{RT}+\ln A$,代入数据得$E_a\approx63.37\,\text{kJ·mol}^{-1}$
- 实际气体更接近理想气体的条件:高温、低压(或气体)