9.1799年英国化学家汉弗莱·戴维发现一氧化二氮(N2O)气体具有轻微的麻醉作用,而且对心脏、肺等器官无伤害,后来被广泛应用于医学手术中。在一定温度下的恒容容器中,反应2N2O(g)===2N2(g)+O2(g)的部分实验数据如下: 反应时 间/min 0 10 20 30 40 50 60 70 80 90 100 c(N2O)/ mol·L-1 0.10 0.09 0.08 0.07 0.06 0.05 0.04 0.03 0.02 0.01 0.00 (1)在0~20min时段,反应速率v(N2O)为________mol·L-1·min-1。(2)若N2O起始浓度c0为0.150mol·L-1,则反应至30min 时N2O的转化率α=________。(3)不同温度(T)下,N2O分解半衰期随起始压强的变化关系如图所示(图中半衰期指任一浓度N2O消耗一半时所需的相应时间),则T1________(填“>”“=”或“<”)T2。当温度为T1、起始压强为p0,反应至t1min时,体系压强p=________(用p0表示)。+ T2-|||-T1-|||-t1-|||-P0 起始压强 /kPa
在一定温度下的恒容容器中,反应2N2O(g)===2N2(g)+O2(g)的部分实验数据如下:
反应时 间/min | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
c(N2O)/ mol·L-1 | 0.10 | 0.09 | 0.08 | 0.07 | 0.06 | 0.05 | 0.04 | 0.03 | 0.02 | 0.01 | 0.00 |
(1)在0~20min时段,反应速率v(N2O)为________mol·L-1·min-1。
(2)若N2O起始浓度c0为0.150mol·L-1,则反应至30min 时N2O的转化率α=________。
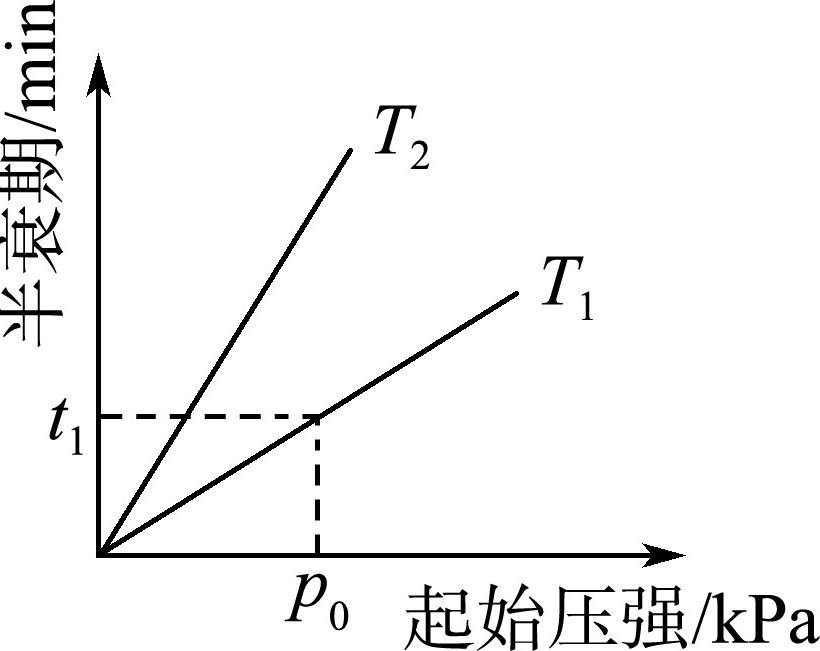
(3)不同温度(T)下,N2O分解半衰期随起始压强的变化关系如图所示(图中半衰期指任一浓度N2O消耗一半时所需的相应时间),则T1________(填“>”“=”或“<”)T2。当温度为T1、起始压强为p0,反应至t1min时,体系压强p=________(用p0表示)。
题目解答
答案
2N2O(g)===2N2(g)+O2(g)
起始量/mol 1 0 0
t1min时/mol 0.5 0.5 0.25
t1min时总物质的量为(0.5+0.5+0.25)mol=1.25mol,根据等温等容条件下,压强之比等于物质的量之比,体系压强p=p0=1.25p0。
答案:(1)1.0×10-3 (2)20.0% (3)> 1.25p0
解析
- 反应速率计算:根据浓度变化与时间的线性关系,直接计算平均速率。
- 转化率分析:通过观察浓度变化规律,发现反应速率与浓度无关(零级反应),利用线性变化规律求解。
- 温度与半衰期关系:温度升高,反应速率加快,半衰期缩短;结合阿伏伽德罗定律分析压强变化。
第(1)题
浓度变化量
$\Delta c = 0.10 \, \text{mol/L} - 0.08 \, \text{mol/L} = 0.02 \, \text{mol/L}$
时间间隔
$\Delta t = 20 \, \text{min}$
反应速率
$v(\text{N}_2\text{O}) = \frac{\Delta c}{\Delta t} = \frac{0.02}{20} = 1.0 \times 10^{-3} \, \text{mol/(L·min)}$
第(2)题
反应规律
每10分钟浓度减少$0.01 \, \text{mol/L}$,30分钟共减少$3 \times 0.01 = 0.03 \, \text{mol/L}$
转化率计算
$\alpha = \frac{\text{转化浓度}}{\text{初始浓度}} \times 100\% = \frac{0.03}{0.150} \times 100\% = 20.0\%$
第(3)题
温度比较
压强相同时,$T_1$的半衰期更短,说明$T_1 > T_2$
压强计算
反应后总物质的量为初始的$1.25$倍,压强比为$1.25$,故$p = 1.25p_0$