题目
辉铜矿的主要成分为Cu2S(含少量Fe2O3、SiO2等杂质)。用辉铜矿冶炼铜的主要工艺流程如图所示:空气 X气体 富氧空气 精铜-|||-磨细-|||-高温脱硫 空气 焦炭-|||-粗铜 吹炼-|||-(含杂质Fe和SiO 2) FeSiO3-|||-金属还原 炉渣-|||-气体(1)铜用于制导线是因为铜具有良好的 ____ 性。(2)“高温脱硫”阶段主要反应的化学方程式为Cu2S+2O2(underline(;高温;))/(;)2X+SO2,X的化学式为 ____ 。(3)“金属还原”阶段生成铜的化学方程式为 ____ 。(4)“吹炼”过程中,杂质与空气中的氧气发生化合反应生成炉渣,参加反应的铁和氧气的质量比为 ____ (填最简整数比)。(5)下列有关说法正确的是 ____ 。A.将辉铜矿磨细的目的是增大接触面积,使氧气充分反应B.“高温脱硫”阶段Cu2S发生了氧化反应C.“金属还原”阶段焦炭的作用是作还原剂和提供热量D.炉渣中FeSiO3里铁元素的化合价为+2价
辉铜矿的主要成分为Cu2S(含少量Fe2O3、SiO2等杂质)。用辉铜矿冶炼铜的主要工艺流程如图所示:
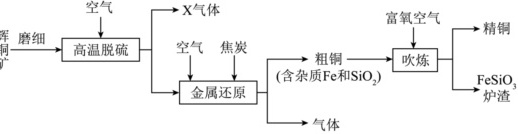
(1)铜用于制导线是因为铜具有良好的 ____ 性。
(2)“高温脱硫”阶段主要反应的化学方程式为Cu2S+2O2$\frac{\underline{\;高温\;}}{\;}$2X+SO2,X的化学式为 ____ 。
(3)“金属还原”阶段生成铜的化学方程式为 ____ 。
(4)“吹炼”过程中,杂质与空气中的氧气发生化合反应生成炉渣,参加反应的铁和氧气的质量比为 ____ (填最简整数比)。
(5)下列有关说法正确的是 ____ 。
A.将辉铜矿磨细的目的是增大接触面积,使氧气充分反应
B.“高温脱硫”阶段Cu2S发生了氧化反应
C.“金属还原”阶段焦炭的作用是作还原剂和提供热量
D.炉渣中FeSiO3里铁元素的化合价为+2价

(1)铜用于制导线是因为铜具有良好的 ____ 性。
(2)“高温脱硫”阶段主要反应的化学方程式为Cu2S+2O2$\frac{\underline{\;高温\;}}{\;}$2X+SO2,X的化学式为 ____ 。
(3)“金属还原”阶段生成铜的化学方程式为 ____ 。
(4)“吹炼”过程中,杂质与空气中的氧气发生化合反应生成炉渣,参加反应的铁和氧气的质量比为 ____ (填最简整数比)。
(5)下列有关说法正确的是 ____ 。
A.将辉铜矿磨细的目的是增大接触面积,使氧气充分反应
B.“高温脱硫”阶段Cu2S发生了氧化反应
C.“金属还原”阶段焦炭的作用是作还原剂和提供热量
D.炉渣中FeSiO3里铁元素的化合价为+2价
题目解答
答案
解:(1)铜用于制导线是因为铜具有良好的导电性;
(2)“高温脱硫”阶段主要反应的化学方程式为Cu2S+2O2$\frac{\underline{\;高温\;}}{\;}$2X+SO2,反应物中有2个铜原子、1个硫原子、4个氧原子,生成物中有1个硫原子、2个氧原子,所以X的化学式为CuO;
(3)“金属还原”阶段生成铜的反应可以是一氧化碳和氧化铜在加热的条件下生成铜和二氧化碳,化学方程式为:CuO+CO $\frac{\underline{\;\;△\;\;}}{\;}$Cu+CO2;
(4)“吹炼”过程中,杂质与空气中的氧气发生化合反应生成炉渣,化学方程式为:2Fe+2SiO2+O2$\frac{\underline{\;高温\;}}{\;}$2FeSiO3,参加反应的铁和氧气的质量比为112:32=7:2;
(5)A、将辉铜矿磨细的目的是增大接触面积,使辉铜矿充分反应,故A错误;
B.“高温脱硫”阶段Cu2S和氧气反应生成了氧化铜和二氧化硫,发生了氧化反应,故B正确;
C、“金属还原”阶段焦炭的作用是作还原剂和提供热量,故C正确;
D、炉渣中FeSiO3里,硅显+4价,氧显-2价,所以铁元素的化合价为+2价,故D正确。
故选:BCD。
故答案为:(1)导电性;
(2)CuO;
(3)CuO+CO $\frac{\underline{\;\;△\;\;}}{\;}$Cu+CO2;
(4)7:2;
(5)BCD。
(2)“高温脱硫”阶段主要反应的化学方程式为Cu2S+2O2$\frac{\underline{\;高温\;}}{\;}$2X+SO2,反应物中有2个铜原子、1个硫原子、4个氧原子,生成物中有1个硫原子、2个氧原子,所以X的化学式为CuO;
(3)“金属还原”阶段生成铜的反应可以是一氧化碳和氧化铜在加热的条件下生成铜和二氧化碳,化学方程式为:CuO+CO $\frac{\underline{\;\;△\;\;}}{\;}$Cu+CO2;
(4)“吹炼”过程中,杂质与空气中的氧气发生化合反应生成炉渣,化学方程式为:2Fe+2SiO2+O2$\frac{\underline{\;高温\;}}{\;}$2FeSiO3,参加反应的铁和氧气的质量比为112:32=7:2;
(5)A、将辉铜矿磨细的目的是增大接触面积,使辉铜矿充分反应,故A错误;
B.“高温脱硫”阶段Cu2S和氧气反应生成了氧化铜和二氧化硫,发生了氧化反应,故B正确;
C、“金属还原”阶段焦炭的作用是作还原剂和提供热量,故C正确;
D、炉渣中FeSiO3里,硅显+4价,氧显-2价,所以铁元素的化合价为+2价,故D正确。
故选:BCD。
故答案为:(1)导电性;
(2)CuO;
(3)CuO+CO $\frac{\underline{\;\;△\;\;}}{\;}$Cu+CO2;
(4)7:2;
(5)BCD。
解析
步骤 1:铜的导电性
铜用于制导线是因为铜具有良好的导电性。
步骤 2:高温脱硫反应
根据质量守恒定律,反应前后原子的种类和数目不变,反应物中有2个铜原子、1个硫原子、4个氧原子,生成物中有1个硫原子、2个氧原子,所以X的化学式为CuO。
步骤 3:金属还原反应
“金属还原”阶段生成铜的反应可以是一氧化碳和氧化铜在加热的条件下生成铜和二氧化碳,化学方程式为:CuO+CO $\frac{\underline{\;\;△\;\;}}{\;}$Cu+CO_2。
步骤 4:吹炼过程中的铁和氧气的质量比
“吹炼”过程中,杂质与空气中的氧气发生化合反应生成炉渣,化学方程式为:2Fe+2SiO_2+O_2$\frac{\underline{\;高温\;}}{\;}$2FeSiO_3,参加反应的铁和氧气的质量比为112:32=7:2。
步骤 5:判断有关说法
A、将辉铜矿磨细的目的是增大接触面积,使辉铜矿充分反应,故A错误;
B.“高温脱硫”阶段Cu_2S和氧气反应生成了氧化铜和二氧化硫,发生了氧化反应,故B正确;
C、“金属还原”阶段焦炭的作用是作还原剂和提供热量,故C正确;
D、炉渣中FeSiO_3里,硅显+4价,氧显-2价,所以铁元素的化合价为+2价,故D正确。
故选:BCD。
铜用于制导线是因为铜具有良好的导电性。
步骤 2:高温脱硫反应
根据质量守恒定律,反应前后原子的种类和数目不变,反应物中有2个铜原子、1个硫原子、4个氧原子,生成物中有1个硫原子、2个氧原子,所以X的化学式为CuO。
步骤 3:金属还原反应
“金属还原”阶段生成铜的反应可以是一氧化碳和氧化铜在加热的条件下生成铜和二氧化碳,化学方程式为:CuO+CO $\frac{\underline{\;\;△\;\;}}{\;}$Cu+CO_2。
步骤 4:吹炼过程中的铁和氧气的质量比
“吹炼”过程中,杂质与空气中的氧气发生化合反应生成炉渣,化学方程式为:2Fe+2SiO_2+O_2$\frac{\underline{\;高温\;}}{\;}$2FeSiO_3,参加反应的铁和氧气的质量比为112:32=7:2。
步骤 5:判断有关说法
A、将辉铜矿磨细的目的是增大接触面积,使辉铜矿充分反应,故A错误;
B.“高温脱硫”阶段Cu_2S和氧气反应生成了氧化铜和二氧化硫,发生了氧化反应,故B正确;
C、“金属还原”阶段焦炭的作用是作还原剂和提供热量,故C正确;
D、炉渣中FeSiO_3里,硅显+4价,氧显-2价,所以铁元素的化合价为+2价,故D正确。
故选:BCD。