题目
纯溶剂中加入非挥发性溶质后,沸点升高。该溶液中溶剂的化学势比未加溶质前:( )(A.)升高 (B.)降低(C.)相等 (D.)不确定
纯溶剂中加入非挥发性溶质后,沸点升高。该溶液中溶剂的化学势比未加溶质前:( )(
A.)升高 (
B.)降低(
C.)相等 (
D.)不确定
A.)升高 (
B.)降低(
C.)相等 (
D.)不确定
题目解答
答案
答:( B)理想稀溶液中溶剂A的化学势: 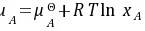 ,xA<1则ln xA<0 ,即加入溶质后溶剂的化学势要降低。
,xA<1则ln xA<0 ,即加入溶质后溶剂的化学势要降低。
解析
考查要点:本题主要考查溶液中溶剂化学势的变化规律,涉及理想稀溶液的化学势表达式及非挥发性溶质对溶剂化学势的影响。
解题核心思路:
- 化学势公式:理想稀溶液中溶剂的化学势公式为 $\mu_A = \mu_A^\theta + RT\ln x_A$,其中 $x_A$ 是溶剂的摩尔分数。
- 溶质的影响:加入非挥发性溶质后,溶剂的摩尔分数 $x_A < 1$,导致 $\ln x_A < 0$,从而使得化学势 $\mu_A$ 降低。
- 物理意义:化学势降低反映溶剂的挥发倾向减弱,对应蒸气压下降,需升高温度(沸点升高)才能达到平衡。
破题关键点:
- 明确化学势公式中 $\ln x_A$ 的符号变化。
- 理解化学势变化与溶液性质(如蒸气压、沸点)的关联。
化学势公式推导:
对于理想稀溶液,溶剂的化学势为:
$\mu_A = \mu_A^\theta + RT\ln x_A$
其中 $\mu_A^\theta$ 是纯溶剂的化学势,$x_A$ 是溶剂的摩尔分数。
加入非挥发性溶质的影响:
- 摩尔分数变化:加入溶质后,溶剂的摩尔分数 $x_A < 1$。
- 对数项符号:$\ln x_A < 0$,因此 $RT\ln x_A$ 为负值。
- 化学势比较:
$\mu_A = \mu_A^\theta + (\text{负值}) \quad \Rightarrow \quad \mu_A < \mu_A^\theta$
即溶剂的化学势比未加溶质前降低。
结论:正确答案为 B。