题目
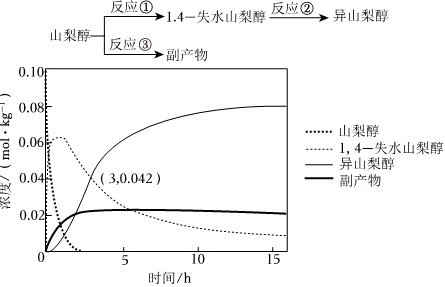
异山梨醇是一种由生物质制备的高附加值化学品,150℃时其制备过程及相关物质浓度随时间变化如图所示,15h后异山梨醇浓度不再变化。下列说法错误的是( )反应①1.4一失水山梨醇反应② 异山梨醇-|||-山梨醇- 反应③副产物-|||-0.10-|||-0.08-|||-山梨醇-|||-0.06 1,4-失水山梨醇-|||-异山梨醇-|||-0.04 (3,0.042) 副产物-|||-0.02-|||-0 5 10 15-|||-时间/hA. 3h时,反应②正、逆反应速率相等B. 该温度下的平衡常数:①>②C. 0~3h平均速率v(异山梨醇)=0.014mol•kg-1•h-1D. 反应②加入催化剂不改变其平衡转化率
异山梨醇是一种由生物质制备的高附加值化学品,150℃时其制备过程及相关物质浓度随时间变化如图所示,15h后异山梨醇浓度不再变化。下列说法错误的是( )

- A. 3h时,反应②正、逆反应速率相等
- B. 该温度下的平衡常数:①>②
- C. 0~3h平均速率v(异山梨醇)=0.014mol•kg-1•h-1
- D. 反应②加入催化剂不改变其平衡转化率
题目解答
答案
解:A.由图可知,3h时,异山梨醇还在增多,反应②没有达到平衡,正、逆反应速率不相等,且V正>V逆,故A错误;
B.由图可知,反应①②达到平衡时,由于①反应的非常彻底,山梨醇剩余浓度几乎为0,说明①反应进行很彻底,平衡常数K很大,而②平衡中,异山梨醇和1,4失水山梨醇共存,且浓度相差不大,故其平衡常数小于①反应的平衡常数,故B正确;
C.由图可知,0~3h平均速率v(异山梨醇)=$\frac{0.042mol•k{g}^{-1}}{3h}$=0.014mol•kg-1•h-1,故C正确;
D.反应②加入催化剂不改变其平衡转化率,但可以加快反应速率,故D正确;
故选:A。
B.由图可知,反应①②达到平衡时,由于①反应的非常彻底,山梨醇剩余浓度几乎为0,说明①反应进行很彻底,平衡常数K很大,而②平衡中,异山梨醇和1,4失水山梨醇共存,且浓度相差不大,故其平衡常数小于①反应的平衡常数,故B正确;
C.由图可知,0~3h平均速率v(异山梨醇)=$\frac{0.042mol•k{g}^{-1}}{3h}$=0.014mol•kg-1•h-1,故C正确;
D.反应②加入催化剂不改变其平衡转化率,但可以加快反应速率,故D正确;
故选:A。
解析
考查要点:本题主要考查化学平衡状态的判断、平衡常数的理解、平均速率的计算以及催化剂对化学平衡的影响。
解题核心思路:
- 平衡状态的判断:通过浓度变化趋势判断是否达到平衡,平衡时正逆反应速率相等。
- 平衡常数比较:根据反应物、产物的浓度变化程度,判断不同反应的平衡常数大小。
- 平均速率计算:利用浓度变化量与时间的比值计算。
- 催化剂的作用:催化剂同等程度改变正逆反应速率,不影响平衡转化率。
破题关键点:
- 选项A需结合图中浓度变化趋势判断反应是否平衡。
- 选项B需通过反应物消耗程度和产物浓度关系比较平衡常数。
- 选项C需注意平均速率的计算公式。
- 选项D需明确催化剂对平衡状态无影响。
选项A分析
关键点:3h时,异山梨醇浓度仍在上升,说明反应②未达平衡,正反应速率大于逆反应速率。
结论:选项A错误。
选项B分析
关键点:
- 反应①中山梨醇浓度几乎为0,说明反应①的平衡常数极大。
- 反应②中异山梨醇与1,4-失水山梨醇浓度相近,说明平衡常数较小。
结论:选项B正确。
选项C分析
计算过程:
平均速率公式为:
$v = \frac{\Delta c}{\Delta t} = \frac{0.042 \, \text{mol·kg}^{-1}}{3 \, \text{h}} = 0.014 \, \text{mol·kg}^{-1}\text{·h}^{-1}$
结论:选项C正确。
选项D分析
关键点:催化剂同等程度改变正逆反应速率,平衡状态不变,因此平衡转化率不变。
结论:选项D正确。