题目
有关溶质质量分数的计算(1)溶质的质量、溶液的质量(或溶剂的质量)、溶质的质量分数之间的换算,直接应用公式。(2)溶液去水浓缩或加水稀释的计算,解此类题目抓住一点:浓缩或稀释前后溶液中溶质的质量不变。即m1·a1%=m2·a2%或m1·a1%=(m1+m水)·a2%(m1·a1%+m2·a2%=(m1+m2)·a%(3)一定质量的溶液中进行溶质质量分数的计算时,涉及溶液体积、密度的计算。应先根据公式m=ρV(即溶液的质量=溶液的密度×溶液的体积)进行换算,或先计算质量,再利用公式进行换算。(4)不同质量分数的同种溶质的溶液混合的计算。m1·a1%+m2·a2%=(m1+m2)·a%(5)溶质的质量分数与化学方程式的综合计算。规律方法探究归类示例一 溶液的形成【例1】溶液是自然界中常见的物质。下列有关溶液的说法正确的是(D)A.溶液一定是均一、稳定、无色、透明的液体B.溶液蒸干后,均能得到固体溶质C.某物质的饱和溶液就是不能再溶解任何物质的溶液D.物质在溶解时,常常会使溶液的温度发生改变解析:溶液是均一、稳定、透明的混合物,但不一定是无色的液体,A项错误;溶液蒸干后,不一定都能得到固体溶质,如盐酸蒸干后不能得到固体溶质,B项错误;某物质的饱和溶液就是不能再溶解该物质的溶液,但可以溶解其他溶质,C项错误;物质在溶解时,常常伴随着能量的变化,因此会使溶液的温度发生改变,D项正确。理解溶液概念的内涵和外延以及溶液的特征、溶质-|||-的状态类型是正确解答的关键。归类示例二 饱和溶液与不饱和溶液【例2】氢氧化钙的溶解度随温度升高而减小。要想把一瓶接近饱和的石灰水变成饱和,具体措施有:①加入氢氧化钙 ②升高温度 ③降低温度 ④加入水 ⑤恒温蒸发水。其中措施正确的是(D)A.①②④B.①③④C.①③⑤D.①②⑤解析:向接近饱和的溶液中增加溶质或蒸发溶剂都可以使溶液变成饱和溶液,故把一瓶接近饱和的石灰水变成饱和,可以采取加入氢氧化钙、恒温蒸发水的方法;由于氢氧化钙的溶解度随温度升高而减小,升高温度后氢氧化钙的溶解度变小,故还可以采取升高温度的方法。理解溶液概念的内涵和外延以及溶液的特征、溶质-|||-的状态类型是正确解答的关键。归类示例三 溶解度曲线的应用【例3】如图是A、B、C三种物质的溶解度曲线,下列说法错误的是()理解溶液概念的内涵和外延以及溶液的特征、溶质-|||-的状态类型是正确解答的关键。A.t1℃时,A、B、C的溶解度由大到小的顺序是C>B>AB.当A中含少量B时,可通过降温结晶的方法提纯AC.升高温度可使接近饱和的C溶液变为饱和D.将t2℃时A、B、C的饱和溶液同时降温至t1℃后,所得溶液中溶质的质量分数由大到小的顺序是C>B>A解析:由A、B、C三种固体物质的溶解度曲线图可知:在t1℃时,三种物质的溶解度从大到小的顺序是C>B>A,A项正确;由于A的溶解度随温度的升高变化较大,B的溶解度随温度的升高变化不大,所以当A中混有少量B时,可用降温结晶的方法提纯A,B项正确;C的溶解度随温度升高而减小,所以升高温度可使接近饱和的C溶液变饱和,C项正确;从t2℃降温到t1℃时A和B的溶解度都减小,都会析出晶体,都还属于饱和溶液,理解溶液概念的内涵和外延以及溶液的特征、溶质-|||-的状态类型是正确解答的关键。由于饱和溶液的溶质质量分数,所以饱和溶液中溶解度大的溶质质量分数就大,t1℃时B的溶解度大于A的,所以B溶液的溶质质量分数大于A的;由于C降温后溶解度增大,变为不饱和溶液,溶质质量分数不变,与t2℃时C的饱和溶液溶质质量分数相同,在t2℃时C物质的溶解度小于t1℃时B的溶解度但大于t1℃时A物质的溶解度,所以降温后溶液中溶质的质量分数由大到小的顺序为B>C>A,故D错误。理解溶液概念的内涵和外延以及溶液的特征、溶质-|||-的状态类型是正确解答的关键。归类示例四 有关溶质质量分数的计算【例4】在20℃时,将下列物质各20 g,分别投入80 g水中,所得溶液中溶质的质量分数为20%的是()A.Na2OB.KNO3C.aOD.CuSO4·5H2O理解溶液概念的内涵和外延以及溶液的特征、溶质-|||-的状态类型是正确解答的关键。理解溶液概念的内涵和外延以及溶液的特征、溶质-|||-的状态类型是正确解答的关键。归类示例五 配制一定质量分数的溶液【例5】某实验小组利用图1所示仪器进行“配制一定质量分数的氯化钠溶液”的实验:理解溶液概念的内涵和外延以及溶液的特征、溶质-|||-的状态类型是正确解答的关键。(1)图1中仪器a的名称是______。(2)完成此实验正确的操作顺序是(填序号)④③①②。①溶解 ②把配好的溶液装入试剂瓶 ③称量 ④计算(3)按实验要求,图1中还缺少的玻璃仪器是(填名称)______。(4)小婧按图2的操作称取氯化钠,小民发现小婧的操作有错误。你认为小婧操作中的错误是______;她称取的氯化钠实际质量为______g。理解溶液概念的内涵和外延以及溶液的特征、溶质-|||-的状态类型是正确解答的关键。(5)小民所取蒸馏水的体积如图3所示,则该实验小组原计划配制的氯化钠溶液中溶质的质量分数为(水的密度约为1 g·cm-3)18%。解析:完成此实验正确的操作顺序是计算、称量、溶解、装瓶存放。称取氯化钠时应注意左物右码,图2中物质的实际质量为15 g-3 g=12 g;原计划该实验配制的氯化钠溶液中溶质质量分数为理解溶液概念的内涵和外延以及溶液的特征、溶质-|||-的状态类型是正确解答的关键。理解溶液概念的内涵和外延以及溶液的特征、溶质-|||-的状态类型是正确解答的关键。自主测试1.下列物质中,属于溶液的是(A)A.苏打水B.冰水C.石灰乳D.液氧解析:苏打水是均一、稳定的混合物,故属于溶液;冰水是纯净物,不属于混合物,故不是溶液;石灰乳是不均一、不稳定的混合物,故不是溶液;液氧是纯净物,不属于混合物,故不是溶液。故选A。2.下列说法中正确的是(C)A.碘酒中的溶剂是水B.把食用油放入水里,并用力振荡,食用油是溶质C.高锰酸钾放入水中,形成紫红色溶液D.将少量氯化钠放入水中溶解,溶剂是氯化钠解析:碘酒中溶剂是酒精,A项错误;食用油不能溶于水,因此食用油不是溶质,B项错误;氯化钠溶液中溶剂是水,溶质是氯化钠,D项错误。3.下列固体溶于水后,溶液温度升高的是(D)①氢氧化钠 ②氯化钠 ③硝酸铵 ④生石灰A.①②③B.①②③④C.①②D.①④解析:氢氧化钠、生石灰、浓硫酸溶于水放热,溶液温度升高;硝酸铵溶于水吸热,溶液温度降低;氯化钠溶于水既不吸热也不放热,故溶液温度不变。4.炎热的夏天,小林从5℃的冰箱冷藏室里拿出一杯底部有少量蔗糖晶体的a溶液。在室温下放置一段时间,发现晶体消失了,得到b溶液。则下列说法错误的是(B)A.5℃时,a溶液一定是饱和溶液B.室温下,b溶液一定是不饱和溶液C.蔗糖晶体的溶解度随温度升高而增大D.b溶液溶质的质量分数一定大于a溶液解析:由题意知,5℃时,a溶液中有少量蔗糖晶体存在,故a溶液一定是饱和溶液,A项正确;在室温下放置一段时间后,发现晶体消失了,b溶液可能恰好饱和,也可能是不饱和溶液,B项错误;从5℃到室温,温度升高,晶体消失说明晶体已经溶解了,从而说明溶解度随温度升高而增大,C项正确;由于a溶液中比b溶液中溶解的溶质少,故b溶液的溶质的质量分数大于a溶液的溶质的质量分数,D项正确。
有关溶质质量分数的计算
(1)溶质的质量、溶液的质量(或溶剂的质量)、溶质的质量分数之间的换算,直接应用公式。
(2)溶液去水浓缩或加水稀释的计算,解此类题目抓住一点:浓缩或稀释前后溶液中溶质的质量不变。
即m1·a1%=m2·a2%
或m1·a1%=(m1+m水)·a2%
(m1·a1%+m2·a2%=(m1+m2)·a%
(3)一定质量的溶液中进行溶质质量分数的计算时,涉及溶液体积、密度的计算。
应先根据公式m=ρV(即溶液的质量=溶液的密度×溶液的体积)进行换算,或先计算质量,再利用公式进行换算。
(4)不同质量分数的同种溶质的溶液混合的计算。
m1·a1%+m2·a2%=(m1+m2)·a%
(5)溶质的质量分数与化学方程式的综合计算。
规律方法探究
归类示例一 溶液的形成
【例1】溶液是自然界中常见的物质。下列有关溶液的说法正确的是(D)
A.溶液一定是均一、稳定、无色、透明的液体
B.溶液蒸干后,均能得到固体溶质
C.某物质的饱和溶液就是不能再溶解任何物质的溶液
D.物质在溶解时,常常会使溶液的温度发生改变
解析:溶液是均一、稳定、透明的混合物,但不一定是无色的液体,A项错误;溶液蒸干后,不一定都能得到固体溶质,如盐酸蒸干后不能得到固体溶质,B项错误;某物质的饱和溶液就是不能再溶解该物质的溶液,但可以溶解其他溶质,C项错误;物质在溶解时,常常伴随着能量的变化,因此会使溶液的温度发生改变,D项正确。

归类示例二 饱和溶液与不饱和溶液
【例2】氢氧化钙的溶解度随温度升高而减小。要想把一瓶接近饱和的石灰水变成饱和,具体措施有:①加入氢氧化钙 ②升高温度 ③降低温度 ④加入水 ⑤恒温蒸发水。其中措施正确的是(D)
A.①②④B.①③④
C.①③⑤D.①②⑤
解析:向接近饱和的溶液中增加溶质或蒸发溶剂都可以使溶液变成饱和溶液,故把一瓶接近饱和的石灰水变成饱和,可以采取加入氢氧化钙、恒温蒸发水的方法;由于氢氧化钙的溶解度随温度升高而减小,升高温度后氢氧化钙的溶解度变小,故还可以采取升高温度的方法。

归类示例三 溶解度曲线的应用
【例3】如图是A、B、C三种物质的溶解度曲线,下列说法错误的是()
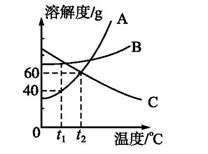
A.t1℃时,A、B、C的溶解度由大到小的顺序是C>B>A
B.当A中含少量B时,可通过降温结晶的方法提纯A
C.升高温度可使接近饱和的C溶液变为饱和
D.将t2℃时A、B、C的饱和溶液同时降温至t1℃后,所得溶液中溶质的质量分数由大到小的顺序是C>B>A
解析:
由A、B、C三种固体物质的溶解度曲线图可知:在t1℃时,三种物质的溶解度从大到小的顺序是C>B>A,A项正确;由于A的溶解度随温度的升高变化较大,B的溶解度随温度的升高变化不大,所以当A中混有少量B时,可用降温结晶的方法提纯A,B项正确;C的溶解度随温度升高而减小,所以升高温度可使接近饱和的C溶液变饱和,C项正确;从t2℃降温到t1℃时A和B的溶解度都减小,都会析出晶体,都还属于饱和溶液,
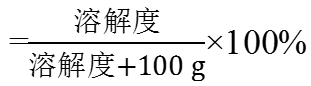 由于饱和溶液的溶质质量分数,所以饱和溶液中溶解度大的溶质质量分数就大,t1℃时B的溶解度大于A的,所以B溶液的溶质质量分数大于A的;由于C降温后溶解度增大,变为不饱和溶液,溶质质量分数不变,与t2℃时C的饱和溶液溶质质量分数相同,在t2℃时C物质的溶解度小于t1℃时B的溶解度但大于t1℃时A物质的溶解度,所以降温后溶液中溶质的质量分数由大到小的顺序为B>C>A,故D错误。
由于饱和溶液的溶质质量分数,所以饱和溶液中溶解度大的溶质质量分数就大,t1℃时B的溶解度大于A的,所以B溶液的溶质质量分数大于A的;由于C降温后溶解度增大,变为不饱和溶液,溶质质量分数不变,与t2℃时C的饱和溶液溶质质量分数相同,在t2℃时C物质的溶解度小于t1℃时B的溶解度但大于t1℃时A物质的溶解度,所以降温后溶液中溶质的质量分数由大到小的顺序为B>C>A,故D错误。
归类示例四 有关溶质质量分数的计算
【例4】在20℃时,将下列物质各20 g,分别投入80 g水中,所得溶液中溶质的质量分数为20%的是()
A.Na2OB.KNO3
C.aOD.CuSO4·5H2O


归类示例五 配制一定质量分数的溶液
【例5】某实验小组利用图1所示仪器进行“配制一定质量分数的氯化钠溶液”的实验:
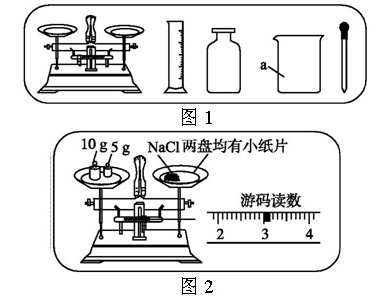
(1)图1中仪器a的名称是______。
(2)完成此实验正确的操作顺序是(填序号)④③①②。
①溶解 ②把配好的溶液装入试剂瓶 ③称量 ④计算
(3)按实验要求,图1中还缺少的玻璃仪器是(填名称)______。
(4)小婧按图2的操作称取氯化钠,小民发现小婧的操作有错误。你认为小婧操作中的错误是______;她称取的氯化钠实际质量
为______g。
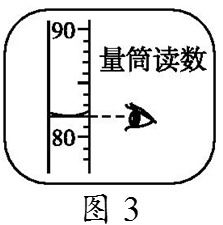
(5)小民所取蒸馏水的体积如图3所示,则该实验小组原计划配制的氯化钠溶液中溶质的质量分数为(水的密度约为1 g·cm-3)18%。
解析:完成此实验正确的操作顺序是计算、称量、溶解、装瓶存放。称取氯化钠时应注意左物右码,图2中物质的实际质量为15 g-3 g=12 g;原计划该实验配制的氯化钠溶液中溶质质量分数为
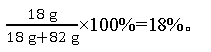

自主测试
1.下列物质中,属于溶液的是(A)
A.苏打水
B.冰水
C.石灰乳
D.液氧
解析:苏打水是均一、稳定的混合物,故属于溶液;冰水是纯净物,不属于混合物,故不是溶液;石灰乳是不均一、不稳定的混合物,故不是溶液;液氧是纯净物,不属于混合物,故不是溶液。故选A。
2.下列说法中正确的是(C)
A.碘酒中的溶剂是水
B.把食用油放入水里,并用力振荡,食用油是溶质
C.高锰酸钾放入水中,形成紫红色溶液
D.将少量氯化钠放入水中溶解,溶剂是氯化钠
解析:碘酒中溶剂是酒精,A项错误;食用油不能溶于水,因此食用油不是溶质,B项错误;氯化钠溶液中溶剂是水,溶质是氯化钠,D项错误。
3.下列固体溶于水后,溶液温度升高的是(D)
①氢氧化钠 ②氯化钠 ③硝酸铵 ④生石灰
A.①②③B.①②③④
C.①②D.①④
解析:氢氧化钠、生石灰、浓硫酸溶于水放热,溶液温度升高;硝酸铵溶于水吸热,溶液温度降低;氯化钠溶于水既不吸热也不放热,故溶液温度不变。
4.炎热的夏天,小林从5℃的冰箱冷藏室里拿出一杯底部有少量蔗糖晶体的a溶液。在室温下放置一段时间,发现晶体消失了,得到b溶液。则下列说法错误的是(B)
A.5℃时,a溶液一定是饱和溶液
B.室温下,b溶液一定是不饱和溶液
C.蔗糖晶体的溶解度随温度升高而增大
D.b溶液溶质的质量分数一定大于a溶液
解析:由题意知,5℃时,a溶液中有少量蔗糖晶体存在,故a溶液一定是饱和溶液,A项正确;在室温下放置一段时间后,发现晶体消失了,b溶液可能恰好饱和,也可能是不饱和溶液,B项错误;从5℃到室温,温度升高,晶体消失说明晶体已经溶解了,从而说明溶解度随温度升高而增大,C项正确;由于a溶液中比b溶液中溶解的溶质少,故b溶液的溶质的质量分数大于a溶液的溶质的质量分数,D项正确。
题目解答
答案
烧杯 玻璃棒 物质和砝码的位置放反了 12.0