题目
已知反应 (H)_(2)(101325Pa)+S(b)_(2)(O)_(3)(UND)leftharpoons 2Sb+(H)_(2)O 在25℃时的 Delta G=-8364J/mol-|||-试计算下列电池的电动势,并指出电池的正负极:-|||-|(H)_(2)(101325Pa)|(H)_(2)O(pH=3)|S(b)_(2)(O)_(3) 固)|Sb

题目解答
答案
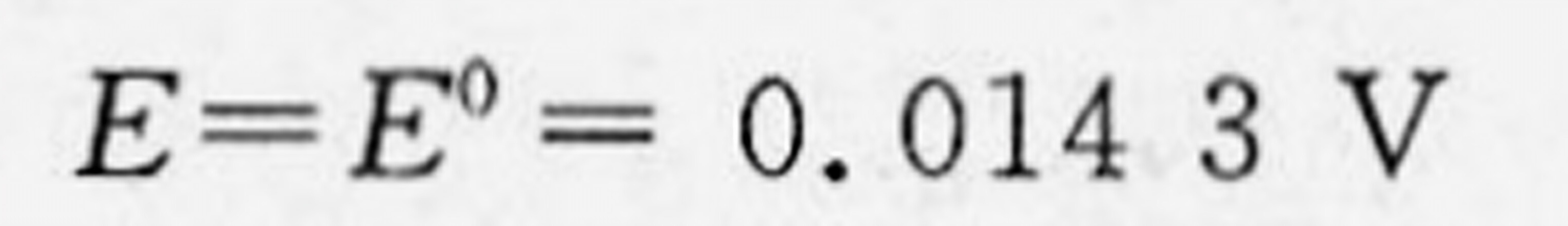
解析
步骤 1:确定电池反应
电池反应为:$3{H}_{2}(g) + S{b}_{2}{O}_{3}(s) \rightleftharpoons 2Sb(s) + {H}_{2}O(l)$
步骤 2:计算标准电极电势
根据给定的 $\Delta G$,可以计算标准电极电势 $E^0$。标准电极电势与标准自由能变化 $\Delta G^0$ 的关系为:$\Delta G^0 = -nFE^0$,其中 $n$ 为反应中转移的电子数,$F$ 为法拉第常数($96485 C/mol$)。
步骤 3:计算电动势
电动势 $E$ 可以通过标准电极电势 $E^0$ 和反应物的活度计算得到。对于氢电极,其电势 $E_{H_2}$ 可以通过公式 $E_{H_2} = E^0_{H_2} + \frac{RT}{nF} \ln a_{H_2}$ 计算,其中 $a_{H_2}$ 为氢气的活度,$E^0_{H_2}$ 为标准氢电极电势($0 V$)。
步骤 4:确定正负极
根据电动势的计算结果,可以确定电池的正负极。电动势为正时,电池的正极是发生氧化反应的一极,负极是发生还原反应的一极。
电池反应为:$3{H}_{2}(g) + S{b}_{2}{O}_{3}(s) \rightleftharpoons 2Sb(s) + {H}_{2}O(l)$
步骤 2:计算标准电极电势
根据给定的 $\Delta G$,可以计算标准电极电势 $E^0$。标准电极电势与标准自由能变化 $\Delta G^0$ 的关系为:$\Delta G^0 = -nFE^0$,其中 $n$ 为反应中转移的电子数,$F$ 为法拉第常数($96485 C/mol$)。
步骤 3:计算电动势
电动势 $E$ 可以通过标准电极电势 $E^0$ 和反应物的活度计算得到。对于氢电极,其电势 $E_{H_2}$ 可以通过公式 $E_{H_2} = E^0_{H_2} + \frac{RT}{nF} \ln a_{H_2}$ 计算,其中 $a_{H_2}$ 为氢气的活度,$E^0_{H_2}$ 为标准氢电极电势($0 V$)。
步骤 4:确定正负极
根据电动势的计算结果,可以确定电池的正负极。电动势为正时,电池的正极是发生氧化反应的一极,负极是发生还原反应的一极。