题目
H2SO4中的S是( )杂化A. spB. sp2C. dsp2D. sp3
H2SO4中的S是( )杂化
- A. sp
- B. sp2
- C. dsp2
- D. sp3
题目解答
答案
解:硫酸的结构式为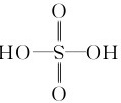 ,中心原子S的价层电子对数为4,VSEPR模型为正四面体,则中心原子S的杂化方式为sp3,故D正确;
,中心原子S的价层电子对数为4,VSEPR模型为正四面体,则中心原子S的杂化方式为sp3,故D正确;
故选:D。
 ,中心原子S的价层电子对数为4,VSEPR模型为正四面体,则中心原子S的杂化方式为sp3,故D正确;
,中心原子S的价层电子对数为4,VSEPR模型为正四面体,则中心原子S的杂化方式为sp3,故D正确;故选:D。
解析
本题考查杂化轨道理论在硫酸分子中的应用。解题核心在于确定硫原子的价层电子对数,进而判断其杂化方式。关键点如下:
-
硫酸的结构:硫原子为中心,通过四个单键(或等价的单双键共振结构)连接四个氧原子。
-
价层电子对数:根据VSEPR理论,价层电子对数 = 成键电子对数 + 孤对电子数。硫原子形成4个σ键,孤对电子数为0,总电子对数为4。
-
杂化类型:价层电子对数为4时,对应sp³杂化,几何构型为正四面体。
-
确定硫原子的成键情况
硫酸分子中,硫原子通过四个单键(或等价的单双键共振结构)与四个氧原子相连,形成4个σ键。 -
计算孤对电子数
硫的价电子数为6,形成4个σ键需使用4个电子,剩余电子数为:
$6 - 4 = 2$
孤对电子数为:
$\frac{2}{2} = 1 \, \text{对}$
但根据硫酸的实际结构,硫的化合价为+6,价层电子数为:
$6 - 6 = 0$
因此,孤对电子数为0。 -
确定价层电子对数
价层电子对数 = 成键电子对数(4) + 孤对电子数(0) = 4。 -
判断杂化方式
价层电子对数为4时,对应sp³杂化,几何构型为正四面体。