题目
作业题25、从湖水中取出深层水,其pH=7.0,含溶解氧质量浓度为0.32 mg/L,请计算pE好Eh。 ( pE=13.2 Eh=0.78 V)
作业题25、从湖水中取出深层水,其pH=7.0,含溶解氧质量浓度为0.32 mg/L,请计算pE好Eh。 ( pE=13.2 Eh=0.78 V)
题目解答
答案
解: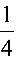 O2 +H++e=
O2 +H++e=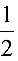 H2O pEo =20.75
H2O pEo =20.75
pE= pEo + lg 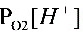
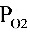 =[O2]aq /KH =1.0×10-5 /1.26×10-8 =0.79×103 Pa
=[O2]aq /KH =1.0×10-5 /1.26×10-8 =0.79×103 Pa
pE= pEo + lg 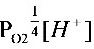 =20.75-7.0-0.53=13.22
=20.75-7.0-0.53=13.22
Eh=0.059pE=0.059×13.22=0.78 V
解析
步骤 1:确定反应方程式
反应方程式为:$\dfrac {1}{4}$ O2 + H+ + e- = $\dfrac {1}{2}$ H2O
步骤 2:计算标准电极电位
标准电极电位 pEo = 20.75
步骤 3:计算氧的分压
氧的分压 Po2 = [O2]aq / KH = 1.0×10-5 / 1.26×10-8 = 0.79×103 Pa
步骤 4:计算pE
pE = pEo + lg ${P}_{{O}_{2}}^{\dfrac {1}{4}}[ {H}^{+}] $ = 20.75 - 7.0 - 0.53 = 13.22
步骤 5:计算Eh
Eh = 0.059pE = 0.059×13.22 = 0.78 V
反应方程式为:$\dfrac {1}{4}$ O2 + H+ + e- = $\dfrac {1}{2}$ H2O
步骤 2:计算标准电极电位
标准电极电位 pEo = 20.75
步骤 3:计算氧的分压
氧的分压 Po2 = [O2]aq / KH = 1.0×10-5 / 1.26×10-8 = 0.79×103 Pa
步骤 4:计算pE
pE = pEo + lg ${P}_{{O}_{2}}^{\dfrac {1}{4}}[ {H}^{+}] $ = 20.75 - 7.0 - 0.53 = 13.22
步骤 5:计算Eh
Eh = 0.059pE = 0.059×13.22 = 0.78 V