题目
8.13 已知H2 SO4的二级解离平衡常数为 https:/img.zuoyebang.cc/zyb_1bcde4f5022640e57e69a4cb3f4f2f61.jpg.0times (10)^-2 ,则 .010molcdot (dm)^-3(H)_(2)S(O)_(4) 溶液的-|||-((H)^+) 为 __ cdot (dm)^-3 ,pH为 __
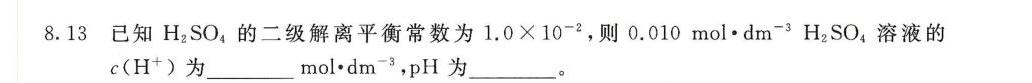
题目解答
答案
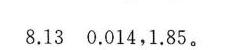
解析
本题考查二元弱酸的分步解离平衡计算。解题关键在于:
- 明确硫酸的分步解离过程:H₂SO₄第一步解离完全,生成H⁺和HSO₄⁻;第二步HSO₄⁻部分解离,需利用二级解离常数K₂计算。
- 建立平衡关系式:根据第二步解离的平衡常数表达式,结合初始浓度和变化量,建立方程求解。
- 判断近似条件:若解离度较大,需舍弃简化假设,直接解二次方程。
步骤1:分析解离过程
- 第一步解离完全:
$\text{H}_2\text{SO}_4 \rightarrow 2\text{H}^+ + \text{SO}_4^{2-}$
但实际第一步解离更准确为:
$\text{H}_2\text{SO}_4 \rightarrow \text{H}^+ + \text{HSO}_4^-$
且解离完全,故初始浓度为:
$[\text{H}^+] = 0.010 \, \text{mol/dm}^3, \quad [\text{HSO}_4^-] = 0.010 \, \text{mol/dm}^3.$
步骤2:第二步解离平衡计算
- 第二步解离方程:
$\text{HSO}_4^- \rightleftharpoons \text{H}^+ + \text{SO}_4^{2-}$
设解离度为$x$,平衡时:
$[\text{H}^+] = 0.010 + x, \quad [\text{SO}_4^{2-}] = x, \quad [\text{HSO}_4^-] = 0.010 - x.$
步骤3:代入平衡常数
- 平衡常数表达式:
$K_2 = \frac{[H^+][\text{SO}_4^{2-}]}{[\text{HSO}_4^-]} = \frac{(0.010 + x)x}{0.010 - x} = 1.0 \times 10^{-2}.$
步骤4:解二次方程
- 展开方程:
$(0.010 + x)x = 1.0 \times 10^{-2}(0.010 - x),$
整理得:
$x^2 + 0.02x - 0.0001 = 0.$ - 求根公式:
$x = \frac{-0.02 \pm \sqrt{0.02^2 + 4 \cdot 0.0001}}{2} \approx 0.00414 \, \text{mol/dm}^3.$
步骤5:计算最终结果
- 总[H⁺]浓度:
$[\text{H}^+] = 0.010 + 0.00414 = 0.014 \, \text{mol/dm}^3.$ - pH值:
$\text{pH} = -\log(0.014) \approx 1.85.$