题目
19.用 .1000molcdot (L)^-1NaOH 溶液滴定 .1000molcdot (L)^-1HAC 至 =8.00 。计算终-|||-点误差。

题目解答
答案
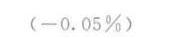
解析
步骤 1:确定滴定终点的pH值
滴定终点的pH值为8.00,这意味着溶液中的氢离子浓度为$10^{-8}mol\cdot L^{-1}$。
步骤 2:计算滴定终点时的氢离子浓度
由于$HAC$的解离常数$K_a$为$1.8 \times 10^{-5}$,我们可以使用$K_a$表达式来计算滴定终点时的氢离子浓度。在滴定终点时,$[H^+] = [OH^-] = 10^{-8}mol\cdot L^{-1}$,因此$[HAC] = [NaAC]$。
步骤 3:计算滴定终点时的$[HAC]$和$[NaAC]$
根据$K_a$表达式,$K_a = \frac{[H^+][AC^-]}{[HAC]}$,代入$K_a = 1.8 \times 10^{-5}$和$[H^+] = 10^{-8}mol\cdot L^{-1}$,可以计算出$[HAC]$和$[NaAC]$的浓度。
步骤 4:计算滴定终点时的$NaOH$和$HAC$的摩尔数
由于$NaOH$和$HAC$的初始浓度相同,且滴定终点时$[HAC] = [NaAC]$,因此可以计算出滴定终点时$NaOH$和$HAC$的摩尔数。
步骤 5:计算终点误差
终点误差可以通过比较滴定终点时$NaOH$和$HAC$的摩尔数来计算。由于$NaOH$和$HAC$的初始浓度相同,因此终点误差可以通过计算$NaOH$和$HAC$的摩尔数之差来确定。
滴定终点的pH值为8.00,这意味着溶液中的氢离子浓度为$10^{-8}mol\cdot L^{-1}$。
步骤 2:计算滴定终点时的氢离子浓度
由于$HAC$的解离常数$K_a$为$1.8 \times 10^{-5}$,我们可以使用$K_a$表达式来计算滴定终点时的氢离子浓度。在滴定终点时,$[H^+] = [OH^-] = 10^{-8}mol\cdot L^{-1}$,因此$[HAC] = [NaAC]$。
步骤 3:计算滴定终点时的$[HAC]$和$[NaAC]$
根据$K_a$表达式,$K_a = \frac{[H^+][AC^-]}{[HAC]}$,代入$K_a = 1.8 \times 10^{-5}$和$[H^+] = 10^{-8}mol\cdot L^{-1}$,可以计算出$[HAC]$和$[NaAC]$的浓度。
步骤 4:计算滴定终点时的$NaOH$和$HAC$的摩尔数
由于$NaOH$和$HAC$的初始浓度相同,且滴定终点时$[HAC] = [NaAC]$,因此可以计算出滴定终点时$NaOH$和$HAC$的摩尔数。
步骤 5:计算终点误差
终点误差可以通过比较滴定终点时$NaOH$和$HAC$的摩尔数来计算。由于$NaOH$和$HAC$的初始浓度相同,因此终点误差可以通过计算$NaOH$和$HAC$的摩尔数之差来确定。