题目
2.19 已知 ^++(e)^-=!=!= Cu E'=+0.52V; ^2++(e)^-=!=!= (Cu)^+ (E)^circ =+-|||-0.15V,则可确定反应 (Cu)^+=!=!= (Cu)^2++Cu 的平衡常数 ^theta 为 ()-|||-a. .7times (10)^8 b. https:/img.zuoyebang.cc/zyb_76c2f9724154ae17af09b9b6b339a4e7.jpg.8times (10)^6 C. .3times (10)^5 d. .9times (10)^4
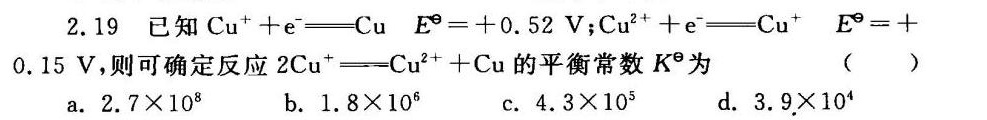
题目解答
答案
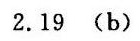
解析
本题考查电化学平衡常数的计算,核心思路是利用标准电极电势计算电池电动势,再通过公式关联平衡常数。关键点在于:
- 确定两个半反应的组合方式,将目标反应拆解为氧化和还原两个半反应;
- 计算标准电动势,公式为 $E^\circ_{\text{cell}} = E^\circ_{\text{cathode}} - E^\circ_{\text{anode}}$;
- 应用公式 $\ln K^\theta = \frac{nFE^\circ_{\text{cell}}}{RT}$,其中 $n$ 为转移电子数。
步骤1:拆分目标反应为氧化和还原半反应
目标反应 $2\text{Cu}^+ \rightarrow \text{Cu}^{2+} + \text{Cu}$ 可拆分为:
- 氧化反应:$\text{Cu}^+ \rightarrow \text{Cu}^{2+} + e^-$(失去1电子)
- 还原反应:$\text{Cu}^+ + e^- \rightarrow \text{Cu}$(获得1电子)
步骤2:确定半反应的电极电势
根据题目给出的半反应:
- $\text{Cu}^+ + e^- \rightarrow \text{Cu}$,$E^\circ = +0.52\,\text{V}$(还原反应,作阴极)
- $\text{Cu}^{2+} + e^- \rightarrow \text{Cu}^+$,$E^\circ = +0.15\,\text{V}$(还原反应,其逆反应作阳极)
阳极反应为 $\text{Cu}^+ \rightarrow \text{Cu}^{2+} + e^-$,对应原反应的逆过程,电势为 $-0.15\,\text{V}$。
步骤3:计算标准电动势
$E^\circ_{\text{cell}} = E^\circ_{\text{cathode}} - E^\circ_{\text{anode}} = 0.52\,\text{V} - 0.15\,\text{V} = 0.37\,\text{V}$
步骤4:计算平衡常数
转移电子数 $n = 1$,代入公式:
$\ln K^\theta = \frac{nFE^\circ_{\text{cell}}}{RT} = \frac{1 \cdot 96485 \cdot 0.37}{8.314 \cdot 298} \approx 14.41$
$K^\theta = e^{14.41} \approx 1.8 \times 10^6$