题目
40.下列说法中正确的是 () 。-|||-(A)BCl3分子中 -C1 键是非极性的-|||-(B)BCl3分子中 -C 键不都是极性的-|||-(C)BCl3分子是极性分子,而 -C1 键是非极性的-|||-(D)BCl3分子是非极性分子,而 B-Cl 键是极性的

题目解答
答案
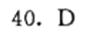
解析
本题考查分子极性与键极性的关系,需明确以下两点:
- 极性键:不同种原子之间形成的共价键(如B-Cl)。
- 极性分子:分子中正负电荷中心不重合,通常由极性键构成且结构不对称。
关键点:
- BCl₃分子为三角平面形结构,对称性导致分子整体非极性,但每个B-Cl键本身是极性的。
选项分析
(A) BCl₃分子中B-Cl键是非极性的
错误。B和Cl是不同种原子,B-Cl键为极性键。
(B) BCl₃分子中B-Cl键不都是极性的
错误。所有B-Cl键均为极性键,不存在非极性键。
(C) BCl₃是极性分子,而B-Cl键是非极性的
错误。若键本身非极性,分子不可能是极性分子;且B-Cl键实际为极性键。
(D) BCl₃是非极性分子,而B-Cl键是极性的
正确。BCl₃分子为三角平面形结构,对称性使各B-Cl键的偶极矩相互抵消,分子整体非极性,但每个键本身是极性的。