题目
34.将0.4897g铬铁矿试样经Na2O2熔融,使其中的 ^3+ 氧化为 ({Cr)_(2)(O)_(7)}^2- 。-|||-然后加入 cdot (L)^-1(H)_(2)S(O)_(4) 及 .00mL0.1202molcdot (L)^-1 硫酸亚铁铵溶-|||-液。过量的 ^2+ 需用15.05 mL K2 Cr2O7标准溶液滴定,而1 mL K2 Cr2O7标准溶-|||-液相当于0.006023g Fe。试求试样中铬的质量分数,若以Cr2O3表示时又为-|||-多少?

题目解答
答案
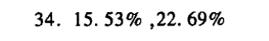
解析
步骤 1:计算过量的Fe2+的量
根据题目,1 mL K2Cr2O7标准溶液相当于0.006023g Fe,因此15.05 mL K2Cr2O7标准溶液相当于的Fe的质量为:
$$
15.05 \times 0.006023 = 0.09066 \text{ g}
$$
步骤 2:计算加入的Fe2+的量
加入的Fe2+的量为:
$$
50.00 \times 0.1202 = 6.01 \text{ mmol}
$$
步骤 3:计算被氧化的Fe2+的量
被氧化的Fe2+的量为:
$$
6.01 - \frac{0.09066}{55.845} = 6.01 - 0.001624 = 6.008376 \text{ mmol}
$$
步骤 4:计算被氧化的Cr3+的量
根据反应方程式,1 mol Cr2O7^2- 可以氧化6 mol Fe2+,因此被氧化的Cr3+的量为:
$$
\frac{6.008376}{6} = 1.001396 \text{ mmol}
$$
步骤 5:计算试样中铬的质量分数
试样中铬的质量分数为:
$$
\frac{1.001396 \times 52}{0.4897} \times 100\% = 15.53\%
$$
步骤 6:计算以Cr2O3表示的铬的质量分数
以Cr2O3表示的铬的质量分数为:
$$
\frac{1.001396 \times 152}{0.4897} \times 100\% = 22.69\%
$$
根据题目,1 mL K2Cr2O7标准溶液相当于0.006023g Fe,因此15.05 mL K2Cr2O7标准溶液相当于的Fe的质量为:
$$
15.05 \times 0.006023 = 0.09066 \text{ g}
$$
步骤 2:计算加入的Fe2+的量
加入的Fe2+的量为:
$$
50.00 \times 0.1202 = 6.01 \text{ mmol}
$$
步骤 3:计算被氧化的Fe2+的量
被氧化的Fe2+的量为:
$$
6.01 - \frac{0.09066}{55.845} = 6.01 - 0.001624 = 6.008376 \text{ mmol}
$$
步骤 4:计算被氧化的Cr3+的量
根据反应方程式,1 mol Cr2O7^2- 可以氧化6 mol Fe2+,因此被氧化的Cr3+的量为:
$$
\frac{6.008376}{6} = 1.001396 \text{ mmol}
$$
步骤 5:计算试样中铬的质量分数
试样中铬的质量分数为:
$$
\frac{1.001396 \times 52}{0.4897} \times 100\% = 15.53\%
$$
步骤 6:计算以Cr2O3表示的铬的质量分数
以Cr2O3表示的铬的质量分数为:
$$
\frac{1.001396 \times 152}{0.4897} \times 100\% = 22.69\%
$$