题目
将一小玻璃瓶放入真空容器中,瓶中已封入1 mol液态水(100℃,101.3 kPa),真空容器恰好能容纳1mol水蒸气(100℃,101.3kPa)。若保持整个系统的温度为100℃,将瓶击破后,水全部气化为水蒸气。试计算此过程的Q,W,ΔU、ΔH、ΔS,ΔA、ΔG。根据计算结果说明此过程是否可逆?用哪一个热力学函数作为判据?已知水在100℃,101.3 kPa的摩尔气化焓为40.64 kJ·mol-1。设蒸气为理想气体。
将一小玻璃瓶放入真空容器中,瓶中已封入1 mol液态水(100℃,101.3 kPa),真空容器恰好能容纳1mol水蒸气(100℃,101.3kPa)。若保持整个系统的温度为100℃,将瓶击破后,水全部气化为水蒸气。试计算此过程的Q,W,ΔU、ΔH、ΔS,ΔA、ΔG。根据计算结果说明此过程是否可逆?用哪一个热力学函数作为判据?
已知水在100℃,101.3 kPa的摩尔气化焓为40.64 kJ·mol-1。设蒸气为理想气体。
题目解答
答案
解:H = 4064 kJ
U = H-( PV )≈H-PVg≈H-nRT
= ( 4064-1×8314×373103) J = 3754 kJ
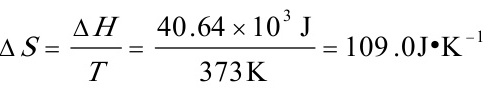
A = U-TS = ( 3754-4064 ) J=-310 kJ
G = H-TS = 0
W = 0
Q = U-W = U = 3754 kJ
ATV < 0,故为不可逆过程。
解析
步骤 1:计算ΔH
根据题目给出的摩尔气化焓,可以直接计算出ΔH。
步骤 2:计算ΔU
利用ΔU = ΔH - Δ(PV)计算ΔU,其中Δ(PV)可以近似为nRT。
步骤 3:计算ΔS
利用ΔS = ΔH / T计算ΔS。
步骤 4:计算ΔA
利用ΔA = ΔU - TΔS计算ΔA。
步骤 5:计算ΔG
利用ΔG = ΔH - TΔS计算ΔG。
步骤 6:计算Q和W
由于整个过程是在恒温下进行的,且没有做功,所以W = 0,Q = ΔU。
步骤 7:判断过程是否可逆
根据ΔA和ΔG的值判断过程是否可逆。
根据题目给出的摩尔气化焓,可以直接计算出ΔH。
步骤 2:计算ΔU
利用ΔU = ΔH - Δ(PV)计算ΔU,其中Δ(PV)可以近似为nRT。
步骤 3:计算ΔS
利用ΔS = ΔH / T计算ΔS。
步骤 4:计算ΔA
利用ΔA = ΔU - TΔS计算ΔA。
步骤 5:计算ΔG
利用ΔG = ΔH - TΔS计算ΔG。
步骤 6:计算Q和W
由于整个过程是在恒温下进行的,且没有做功,所以W = 0,Q = ΔU。
步骤 7:判断过程是否可逆
根据ΔA和ΔG的值判断过程是否可逆。