题目
三草酸合铁(Ⅲ)酸钾(K3[Fe(C2O4)3]•3H2O)是一种经典的光敏剂,也是制备负载型活性铁催化剂的主要原料。用废铁铬(含少量Al2O3、Fe2O3)先制备草酸铁,然后再制备三草酸合铁(Ⅲ)酸钾。Ⅰ.制备草酸亚铁过量废铁屑 碳酸钠 K2C2O4-|||-稀硫酸 反应I 调节pH 过滤 FeSO4 反应Ⅱ → 过滤 →FeC2O4·2H2O溶液-|||-滤渣已知:部分氢氧化物沉淀时溶液的pH如下表: 沉淀物 Fe(OH)3 Fe(OH)2 Al(OH)3 开始沉淀 2.3 7.5 3.4 完全沉淀 3.2 9.7 4.4 (1)加入过量废铁屑的主要目的是 ____ (双选)。A.提高铁的利用率B.除去溶液中的Fe3+C.防止Fe2+被氧化D.抑制Fe2+的水解(2)加入少量Na2CO3后,混合溶液pH范围应调控在 ____ 。A.3.2以下B.3.2∼3.4C.4.4∼7.5D.7.5以上(3)写出反应Ⅱ的离子方程式: ____ 。(4)关于K2C2O4溶液中有关离子浓度的说法正确的是 ____ (不定项)。A.[K+]+[H+]=2[C2(O)_(4)^2-]+[HC2(O)_(4)^-]+[OH-]B.2[K+]=[C2(O)_(4)^2-]+[HC2(O)_(4)^-]+[H2C2O4]C.[HC2(O)_(4)^-]+[H2C2O4]+[H+]=[OH-]D.对溶液进行稀释,[C2(O)_(4)^2-]与[HC2(O)_(4)^-]的比值变小Ⅱ.制备三草酸合铁(Ⅲ)酸钾步骤一:在草酸亚铁固体中,加入饱和K2C2O4溶液;步骤二:保持恒温40℃,边搅拌边缓慢加入3%H2O2溶液,直至氧化完全;步骤三:将溶液加热至沸,加入饱和H2C2O4溶液,溶液转为绿色,获得三草酸合铁(Ⅲ)酸钾溶液。(5)从步骤三所得溶液获得三草酸合铁(Ⅲ)酸钾晶体的操作依次为水浴浓缩、 ____ 、 ____ ,然后用乙醇淋洗。(6)步骤二使用H2O2做氧化剂,其优点是 ____ ;滴加H2O2时需保持恒温40℃,原因是 ____ 。(7)三草酸合铁(Ⅲ)酸钾溶液中存在如下过程:[Fe(C2O4)3]3-(aq)⇌Fe3+(aq)+C2(O)_(4)^2-(aq),某同学想检验C2(O)_(4)^2-的存在,结合CaC2O4属于难溶电解质的特点,他向三草酸合铁(Ⅲ)酸钾溶液中加入CaCl2溶液,并未看到有沉淀生成。从平衡角度解释上述现象 ____ 。Ⅲ.三草酸合铁(Ⅲ)酸钾含量测定测定三草酸合铁(Ⅲ)酸钾样品纯度的方法如下:称取样品0.2415g,放入250mL锥形瓶中,加入25mL水和5mL1mol•L-1H2SO4,用0.0200mol•L-1KMnO4标准溶液滴定至终点,反应原理为:2KMnO4+5H2C2O4+3H2SO4═2MnSO4+K2SO4+10CO2↑+8H2O(8)确认滴定终点的操作是 ____ 。(9)若最终消耗KMnO4标准溶液23.19mL,则样品纯度为 ____ (精确到0.1%)。(已知K3[Fe(C2O4)3]•3H2O的摩尔质量为491g•mol-1)
三草酸合铁(Ⅲ)酸钾(K3[Fe(C2O4)3]•3H2O)是一种经典的光敏剂,也是制备负载型活性铁催化剂的主要原料。用废铁铬(含少量Al2O3、Fe2O3)先制备草酸铁,然后再制备三草酸合铁(Ⅲ)酸钾。
Ⅰ.制备草酸亚铁
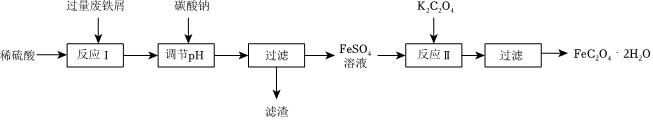
已知:部分氢氧化物沉淀时溶液的pH如下表:
(1)加入过量废铁屑的主要目的是 ____ (双选)。
A.提高铁的利用率
B.除去溶液中的Fe3+
C.防止Fe2+被氧化
D.抑制Fe2+的水解
(2)加入少量Na2CO3后,混合溶液pH范围应调控在 ____ 。
A.3.2以下
B.3.2∼3.4
C.4.4∼7.5
D.7.5以上
(3)写出反应Ⅱ的离子方程式: ____ 。
(4)关于K2C2O4溶液中有关离子浓度的说法正确的是 ____ (不定项)。
A.[K+]+[H+]=2[C2${O}_{4}^{2-}$]+[HC2${O}_{4}^{-}$]+[OH-]
B.2[K+]=[C2${O}_{4}^{2-}$]+[HC2${O}_{4}^{-}$]+[H2C2O4]
C.[HC2${O}_{4}^{-}$]+[H2C2O4]+[H+]=[OH-]
D.对溶液进行稀释,[C2${O}_{4}^{2-}$]与[HC2${O}_{4}^{-}$]的比值变小
Ⅱ.制备三草酸合铁(Ⅲ)酸钾
步骤一:在草酸亚铁固体中,加入饱和K2C2O4溶液;
步骤二:保持恒温40℃,边搅拌边缓慢加入3%H2O2溶液,直至氧化完全;
步骤三:将溶液加热至沸,加入饱和H2C2O4溶液,溶液转为绿色,获得三草酸合铁(Ⅲ)酸钾溶液。
(5)从步骤三所得溶液获得三草酸合铁(Ⅲ)酸钾晶体的操作依次为水浴浓缩、 ____ 、 ____ ,然后用乙醇淋洗。
(6)步骤二使用H2O2做氧化剂,其优点是 ____ ;滴加H2O2时需保持恒温40℃,原因是 ____ 。
(7)三草酸合铁(Ⅲ)酸钾溶液中存在如下过程:[Fe(C2O4)3]3-(aq)⇌Fe3+(aq)+C2${O}_{4}^{2-}$(aq),某同学想检验C2${O}_{4}^{2-}$的存在,结合CaC2O4属于难溶电解质的特点,他向三草酸合铁(Ⅲ)酸钾溶液中加入CaCl2溶液,并未看到有沉淀生成。从平衡角度解释上述现象 ____ 。
Ⅲ.三草酸合铁(Ⅲ)酸钾含量测定
测定三草酸合铁(Ⅲ)酸钾样品纯度的方法如下:
称取样品0.2415g,放入250mL锥形瓶中,加入25mL水和5mL1mol•L-1H2SO4,用0.0200mol•L-1KMnO4标准溶液滴定至终点,反应原理为:
2KMnO4+5H2C2O4+3H2SO4═2MnSO4+K2SO4+10CO2↑+8H2O
(8)确认滴定终点的操作是 ____ 。
(9)若最终消耗KMnO4标准溶液23.19mL,则样品纯度为 ____ (精确到0.1%)。
(已知K3[Fe(C2O4)3]•3H2O的摩尔质量为491g•mol-1)
Ⅰ.制备草酸亚铁

已知:部分氢氧化物沉淀时溶液的pH如下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
A.提高铁的利用率
B.除去溶液中的Fe3+
C.防止Fe2+被氧化
D.抑制Fe2+的水解
(2)加入少量Na2CO3后,混合溶液pH范围应调控在 ____ 。
A.3.2以下
B.3.2∼3.4
C.4.4∼7.5
D.7.5以上
(3)写出反应Ⅱ的离子方程式: ____ 。
(4)关于K2C2O4溶液中有关离子浓度的说法正确的是 ____ (不定项)。
A.[K+]+[H+]=2[C2${O}_{4}^{2-}$]+[HC2${O}_{4}^{-}$]+[OH-]
B.2[K+]=[C2${O}_{4}^{2-}$]+[HC2${O}_{4}^{-}$]+[H2C2O4]
C.[HC2${O}_{4}^{-}$]+[H2C2O4]+[H+]=[OH-]
D.对溶液进行稀释,[C2${O}_{4}^{2-}$]与[HC2${O}_{4}^{-}$]的比值变小
Ⅱ.制备三草酸合铁(Ⅲ)酸钾
步骤一:在草酸亚铁固体中,加入饱和K2C2O4溶液;
步骤二:保持恒温40℃,边搅拌边缓慢加入3%H2O2溶液,直至氧化完全;
步骤三:将溶液加热至沸,加入饱和H2C2O4溶液,溶液转为绿色,获得三草酸合铁(Ⅲ)酸钾溶液。
(5)从步骤三所得溶液获得三草酸合铁(Ⅲ)酸钾晶体的操作依次为水浴浓缩、 ____ 、 ____ ,然后用乙醇淋洗。
(6)步骤二使用H2O2做氧化剂,其优点是 ____ ;滴加H2O2时需保持恒温40℃,原因是 ____ 。
(7)三草酸合铁(Ⅲ)酸钾溶液中存在如下过程:[Fe(C2O4)3]3-(aq)⇌Fe3+(aq)+C2${O}_{4}^{2-}$(aq),某同学想检验C2${O}_{4}^{2-}$的存在,结合CaC2O4属于难溶电解质的特点,他向三草酸合铁(Ⅲ)酸钾溶液中加入CaCl2溶液,并未看到有沉淀生成。从平衡角度解释上述现象 ____ 。
Ⅲ.三草酸合铁(Ⅲ)酸钾含量测定
测定三草酸合铁(Ⅲ)酸钾样品纯度的方法如下:
称取样品0.2415g,放入250mL锥形瓶中,加入25mL水和5mL1mol•L-1H2SO4,用0.0200mol•L-1KMnO4标准溶液滴定至终点,反应原理为:
2KMnO4+5H2C2O4+3H2SO4═2MnSO4+K2SO4+10CO2↑+8H2O
(8)确认滴定终点的操作是 ____ 。
(9)若最终消耗KMnO4标准溶液23.19mL,则样品纯度为 ____ (精确到0.1%)。
(已知K3[Fe(C2O4)3]•3H2O的摩尔质量为491g•mol-1)
题目解答
答案
解:(1)亚铁离子容易被空气中氧气氧化,且溶液中铁离子能和铁生成亚铁离子,故加入过量废铁屑的主要目的是:提高铁的利用率、除去溶液中的Fe2+、防止Fe2+被氧化,
故答案为:ABC;
(2)加入少量Na2CO3后,需要将铝离子转化为沉淀而亚铁离子不沉淀,结合表可知,混合溶液pH范围应调控在4.4~7.5,
故答案为:C;
(3)反应Ⅱ为硫酸亚铁和草酸钾得到草酸亚铁晶体沉淀,反应为Fe2++C2${O}_{4}^{2-}$+2H2O=FeC2O4•2H2O↓,
故答案为:Fe2++C2${O}_{4}^{2-}$+2H2O=FeC2O4•2H2O↓;
(4)A.由电荷守恒可知,.[K+]+[H+]=2[C2${O}_{4}^{2-}$]+[HC2${O}_{4}^{-}$]+[OH-],故A正确;
B.由物料守恒可知,[K+]=2[C2${O}_{4}^{2-}$]+2[HC2${O}_{4}^{-}$]+2[H2C2O4],故B错误;
C.由质子守恒可知,[HC2${O}_{4}^{-}$]+2[H2C2O4]+[H+]=[OH-],故C错误;
D.$\frac{c({C}_{2}{O}_{4}^{2-})}{c(H{C}_{2}{O}_{4}^{-})}$=$\frac{{K}_{a2}}{{K}_{w}}$,K2C2O4溶液显碱性,对溶液进行稀释,溶液的碱性变弱,则氢氧根离子浓度减小,故[C2${O}_{4}^{2-}$]与[HC2${O}_{4}^{-}$]的比值变小,故D正确;
故答案为:AD;
(5)从步骤三所得溶液获得三草酸合铁(Ⅲ)酸钾晶体的操作依次为水浴浓缩、冷却结晶、过滤,然后用乙醇淋洗,
故答案为:冷却结晶;过滤;
(6)过氧化氢作为氧化剂,反应后生成水,不引入其它杂质,由于过氧化氢不稳定,受热易分解,故滴加H2O2时需保持恒温40℃,
故答案为:反应后生成水,不引入其它杂质;过氧化氢不稳定,受热易分解;
(7)三草酸合铁(Ⅲ)酸钾溶液中加入CaCl2溶液,并未看到有沉淀生成,原因是加入钙离子后Q(CaC2O4)<Ksp(CaC2O4),不足以使CaC2O4(s)⇌Ca2+(aq)+C2${O}_{4}^{2-}$(aq)平衡向生成草酸钙沉淀的方向移动,故无沉淀生成,
故答案为:加入钙离子后Q(CaC2O4)<Ksp(CaC2O4),不足以使CaC2O4(s)⇌Ca2+(aq)+C2${O}_{4}^{2-}$(aq)平衡向生成草酸钙沉淀的方向移动,故无沉淀生成;
(8)高锰酸钾溶液为紫色溶液,和草酸反应生成锰离子,锰离子无色故确认滴定终点的操作是:最后半滴标准液加入后,溶液变红色,且半分钟内不褪色,
故答案为:最后半滴标准液加入后,溶液变红色,且半分钟内不褪色;
(9)由根据2KMnO4+5H2C2O4+3H2SO4═2MnSO4+K2SO4+10CO2↑+8H2O和三草酸合铁(Ⅲ)酸钾化学式,样品纯度为$\frac{0.0200mol/L×23.19×1{0}^{-3}L×\frac{5}{2}×\frac{1}{3}×491g/mo}{0.2415g}$×100%≈78.6%,
故答案为:78.6%。
故答案为:ABC;
(2)加入少量Na2CO3后,需要将铝离子转化为沉淀而亚铁离子不沉淀,结合表可知,混合溶液pH范围应调控在4.4~7.5,
故答案为:C;
(3)反应Ⅱ为硫酸亚铁和草酸钾得到草酸亚铁晶体沉淀,反应为Fe2++C2${O}_{4}^{2-}$+2H2O=FeC2O4•2H2O↓,
故答案为:Fe2++C2${O}_{4}^{2-}$+2H2O=FeC2O4•2H2O↓;
(4)A.由电荷守恒可知,.[K+]+[H+]=2[C2${O}_{4}^{2-}$]+[HC2${O}_{4}^{-}$]+[OH-],故A正确;
B.由物料守恒可知,[K+]=2[C2${O}_{4}^{2-}$]+2[HC2${O}_{4}^{-}$]+2[H2C2O4],故B错误;
C.由质子守恒可知,[HC2${O}_{4}^{-}$]+2[H2C2O4]+[H+]=[OH-],故C错误;
D.$\frac{c({C}_{2}{O}_{4}^{2-})}{c(H{C}_{2}{O}_{4}^{-})}$=$\frac{{K}_{a2}}{{K}_{w}}$,K2C2O4溶液显碱性,对溶液进行稀释,溶液的碱性变弱,则氢氧根离子浓度减小,故[C2${O}_{4}^{2-}$]与[HC2${O}_{4}^{-}$]的比值变小,故D正确;
故答案为:AD;
(5)从步骤三所得溶液获得三草酸合铁(Ⅲ)酸钾晶体的操作依次为水浴浓缩、冷却结晶、过滤,然后用乙醇淋洗,
故答案为:冷却结晶;过滤;
(6)过氧化氢作为氧化剂,反应后生成水,不引入其它杂质,由于过氧化氢不稳定,受热易分解,故滴加H2O2时需保持恒温40℃,
故答案为:反应后生成水,不引入其它杂质;过氧化氢不稳定,受热易分解;
(7)三草酸合铁(Ⅲ)酸钾溶液中加入CaCl2溶液,并未看到有沉淀生成,原因是加入钙离子后Q(CaC2O4)<Ksp(CaC2O4),不足以使CaC2O4(s)⇌Ca2+(aq)+C2${O}_{4}^{2-}$(aq)平衡向生成草酸钙沉淀的方向移动,故无沉淀生成,
故答案为:加入钙离子后Q(CaC2O4)<Ksp(CaC2O4),不足以使CaC2O4(s)⇌Ca2+(aq)+C2${O}_{4}^{2-}$(aq)平衡向生成草酸钙沉淀的方向移动,故无沉淀生成;
(8)高锰酸钾溶液为紫色溶液,和草酸反应生成锰离子,锰离子无色故确认滴定终点的操作是:最后半滴标准液加入后,溶液变红色,且半分钟内不褪色,
故答案为:最后半滴标准液加入后,溶液变红色,且半分钟内不褪色;
(9)由根据2KMnO4+5H2C2O4+3H2SO4═2MnSO4+K2SO4+10CO2↑+8H2O和三草酸合铁(Ⅲ)酸钾化学式,样品纯度为$\frac{0.0200mol/L×23.19×1{0}^{-3}L×\frac{5}{2}×\frac{1}{3}×491g/mo}{0.2415g}$×100%≈78.6%,
故答案为:78.6%。