请说明下列公式的使用条件 (3分) (1) dS = Q/dT (2)ΔH = nCp;m(T2-T1) (3)ΔG =ΔH - TΔS答:(1)dS = Q/dT :可逆过程 (2)ΔH = nCp;m(T2-T1) :恒压且热容与温度无关 (3)ΔG =ΔH – TΔS :恒温;是非题.( )能发生的过程一定是自发过程。.( )功可以全部转变成热;但热一定不能全部转化为功。.( )从单一热源吸取热量而全部变为功是可能的。.( )家里没有空调;可以打开冰箱门来代替空调达到降温的目的。.( )所有绝热过程的Q为零;△S也必为零。.( )熵值不可能为负值。.( )某一化学反应的热效应被反应温度T除;即得此反应的.( )因为;所以只有可逆过程才有熵变;而;扬以不可逆过程只有热温商;没有熵变。.( )物质的标准熵值是该状态下熵的绝对值。.( )理想气体绝热可逆过程的△S一定为零;△G不一定为零。.( )体系达到平衡时熵值最大;吉布斯函数最小。.( )在绝热恒容的反应器中;H2和Cl2化合成HCl;此过程的为零。.( )水在100℃;102325Pa下沸腾;吉布斯函数会减少。.( )△G代表在恒温恒压条件下;体系对外做功的最大能力。.( )隔离体系的熵恒定不变。.( )不可逆过程必为自发过程。.( )ΔrGm>0的反应;是不可能进行的反应。;填空题.一个过程系统的熵变为△S; 而另一个过程的始终态与前过程相同;但路径不同;则此过程系统的熵变应为__△S___。(1分)因为状态函数与过程无关.0 ℃; 101.3 kPa下; 1 mol冰熔化成水; 吸热 6.02 kJ;此过程 △G =0..液体水在100℃;下气化为水蒸气;此过程的ΔU > 0;ΔH > 0;ΔS= > 0;ΔG = 0(填“>”、“<”或“=”.101.3 kPa下; 1 kg 100 ℃的水蒸气冷凝为同温度下的水;此过程 △S(系统)<0; △S(总) =0 ( 填 >; < 或 = ).;计算题.(15分)101.3 kPa下; 1 mol的 100 ℃水与 100 ℃的大热源相接触; 经过两种不同的过程到达终态 100 ℃; 101.3 kPa的水蒸气: (1)保持压力不变; (2)向真空膨胀.试分别计算这两种过程的 Q; W;△U;△H;△S;△A及△G 并判断过程是否可逆.已知 100℃;101.3 kPa下水的气化热△vapH = 40.71 kJ.mol; V(l) = 18.8×10 m.mol; V(g) = 3.02×10 m.mol.
请说明下列公式的使用条件 (3分)
(1) dS = Q/dT (2)ΔH = nCp;m(T2-T1) (3)ΔG =ΔH - TΔS
答:(1)dS = Q/dT :可逆过程 (2)ΔH = nCp;m(T2-T1) :恒压且热容与温度无关
(3)ΔG =ΔH – TΔS :恒温
;是非题
.( )能发生的过程一定是自发过程。
.( )功可以全部转变成热;但热一定不能全部转化为功。
.( )从单一热源吸取热量而全部变为功是可能的。
.( )家里没有空调;可以打开冰箱门来代替空调达到降温的目的。
.( )所有绝热过程的Q为零;△S也必为零。
.( )熵值不可能为负值。
.( )某一化学反应的热效应被反应温度T除;即得此反应的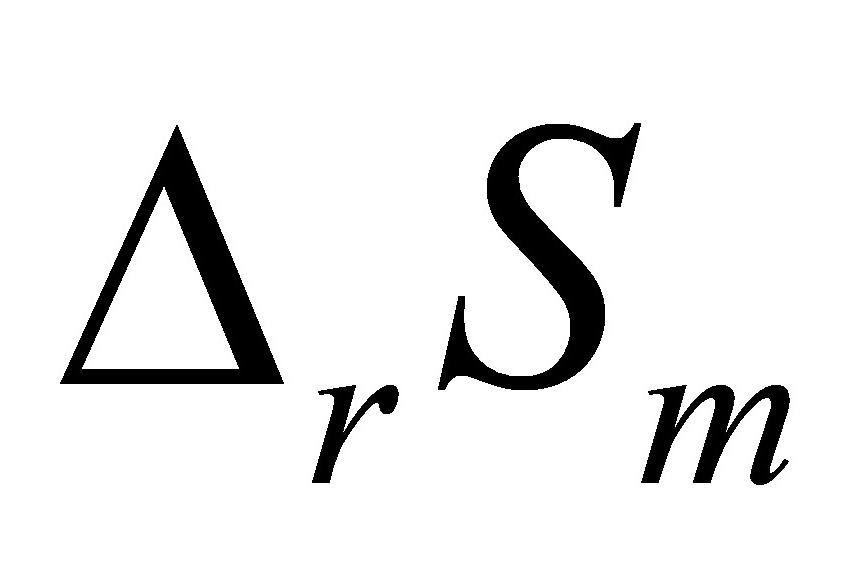
.( )因为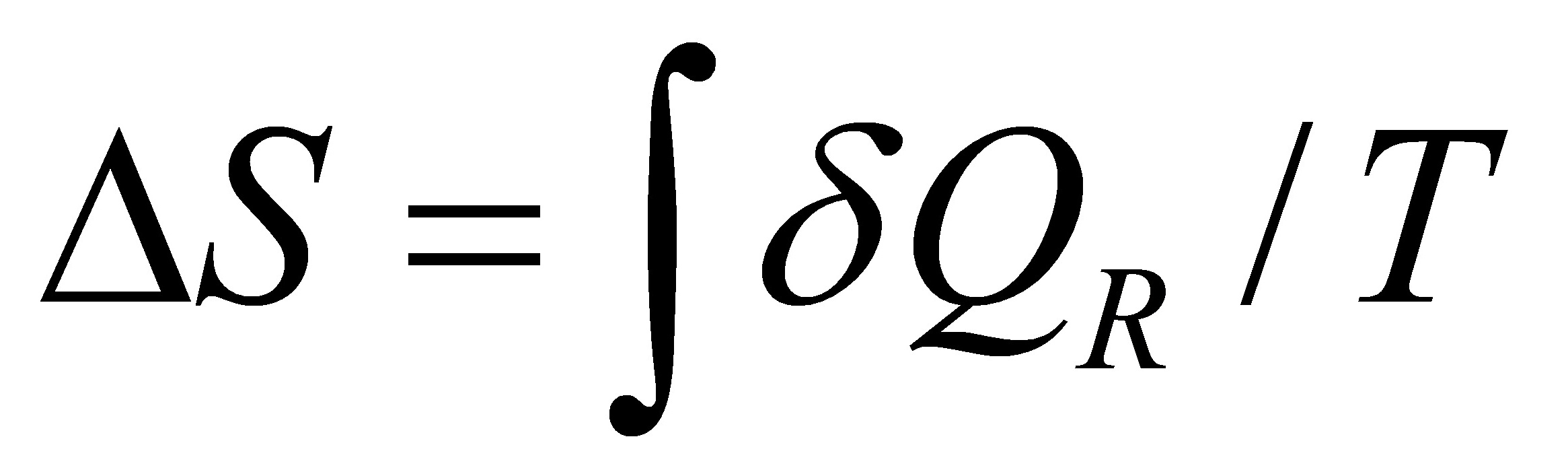 ;所以只有可逆过程才有熵变;而
;所以只有可逆过程才有熵变;而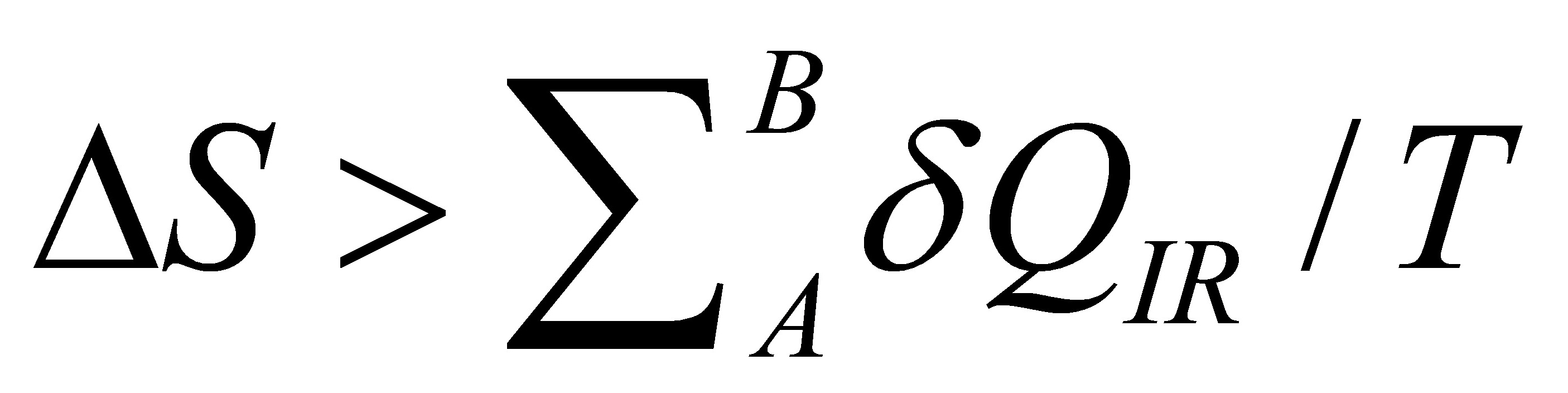 ;扬以不可逆过程只有热温商;没有熵变。
;扬以不可逆过程只有热温商;没有熵变。
.( )物质的标准熵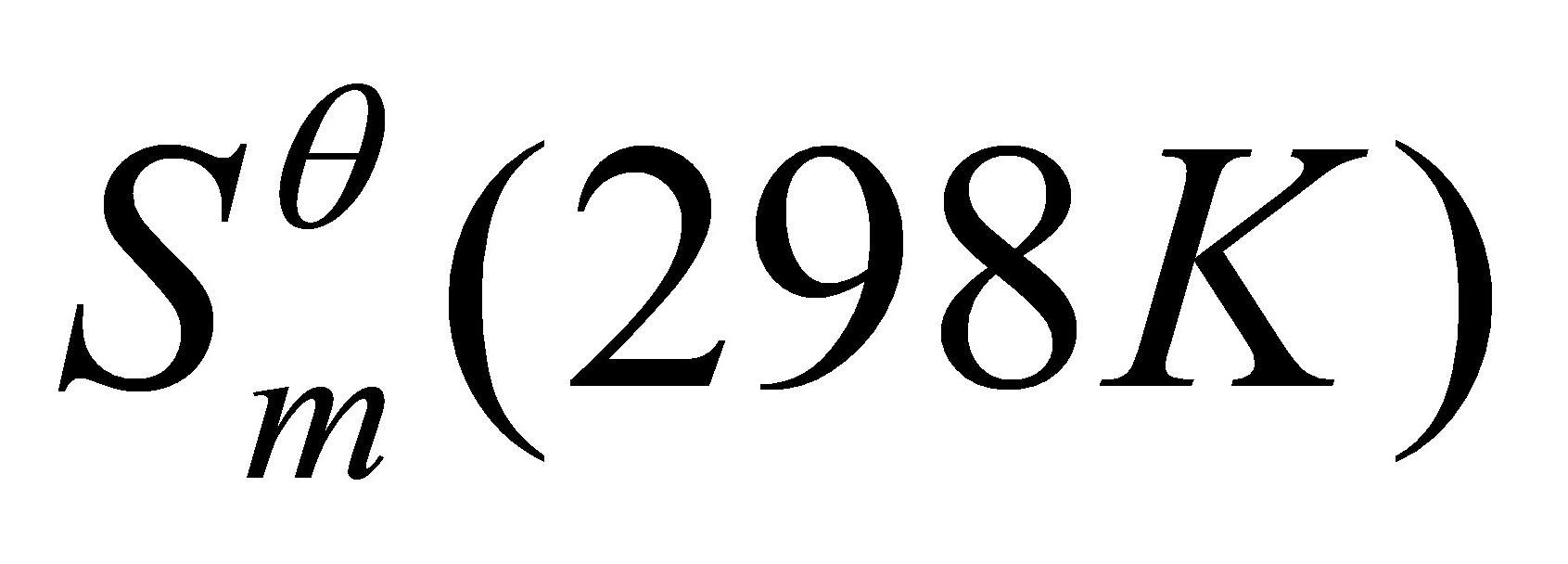 值是该状态下熵的绝对值。
值是该状态下熵的绝对值。
.( )理想气体绝热可逆过程的△S一定为零;△G不一定为零。
.( )体系达到平衡时熵值最大;吉布斯函数最小。
.( )在绝热恒容的反应器中;H2和Cl2化合成HCl;此过程的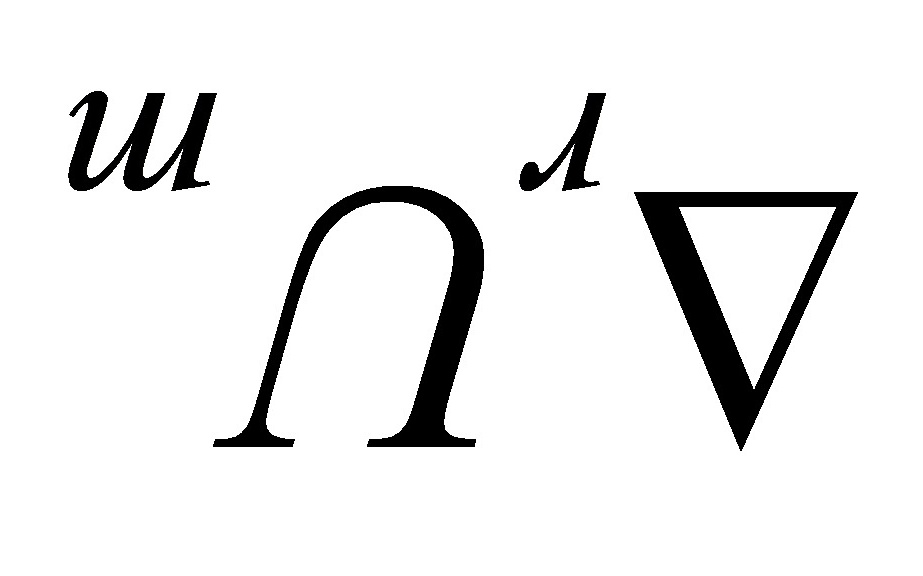 为零。
为零。
.( )水在100℃;102325Pa下沸腾;吉布斯函数会减少。
.( )△G代表在恒温恒压条件下;体系对外做功的最大能力。
.( )隔离体系的熵恒定不变。
.( )不可逆过程必为自发过程。
.( )ΔrGm>0的反应;是不可能进行的反应。
;填空题
.一个过程系统的熵变为△S; 而另一个过程的始终态与前过程相同;但路径不同;则此过程系统的熵变应为__△S___。(1分)
因为状态函数与过程无关
.0 ℃; 101.3 kPa下; 1 mol冰熔化成水; 吸热 6.02 kJ;此过程 △G =0.
.液体水在100℃;下气化为水蒸气;此过程的
ΔU > 0;ΔH > 0;ΔS= > 0;ΔG = 0
(填“>”、“<”或“=”
.101.3 kPa下; 1 kg 100 ℃的水蒸气冷凝为同温度下的水;此过程 △S(系统)
<0; △S(总) =0 ( 填 >; < 或 = ).
;计算题
.(15分)101.3 kPa下; 1 mol的 100 ℃水与 100 ℃的大热源相接触; 经过两种不同的过程到达终态 100 ℃; 101.3 kPa的水蒸气: (1)保持压力不变; (2)向真空膨胀.试分别计算这两种过程的 Q; W;△U;△H;△S;△A及△G 并判断过程是否可逆.已知 100℃;101.3 kPa下水的气化热△vapH = 40.71 kJ.mol; V(l) = 18.8×10 m.mol; V(g) = 3.02×10 m.mol.
题目解答
答案
解: (1) W = - △V = - 101.3×103×(3.02×10-2-18.8×10-6) = - 3.06 kJ
Q = △H = 40.71 kJ
△U = Q + W = 40.71 - 3.06 = 37.65 kJ
△S = Q/T = 40.71×10-3/373 = 109.1 J.K
△A = △U - T△S = 37.65 - 40.71 = - 3.06 kJ
△G = 0
∵ 在沸点下蒸发;故为可逆过程.由 △G = 0 也可判断.
(2) W =0
△U = 37.65 kJ △H = 40.71 kJ △S = 109.1 J.K △A = - 3.06 kJ △G = 0
Q =△U-W=37.65 kJ
△S(环) = - Q/T = - (△U-W)/T = - 37.65×10-3/373 = - 100.9 J.K
△S(总) = △S + △S(环) = 109.1 - 100.9 = 8.2 J.K-1 > 0 过程(2)为不可逆过程.
.(16分)1mol甲苯(l)在正常沸点383.2K可逆蒸发为蒸气;设蒸气可视为理想气体;求过程的Q、W、△U、△H、△S、△S、△G和△A。已知正常沸点处△H(甲苯;l)=33.3kJ·mol。
解: 4分
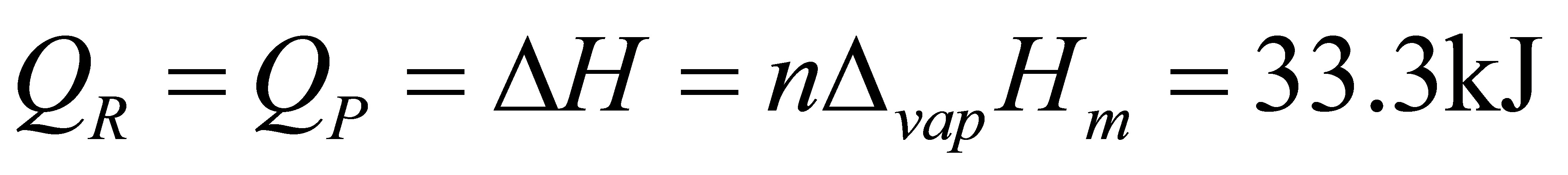 2分
2分
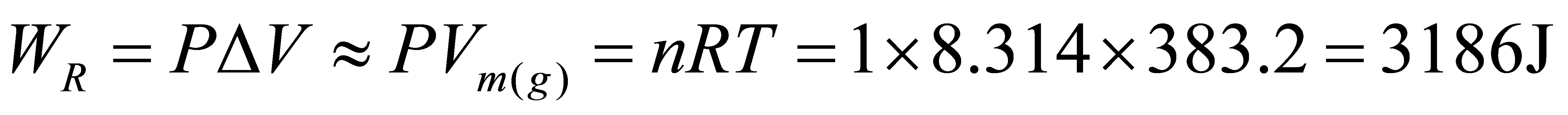 2分
2分
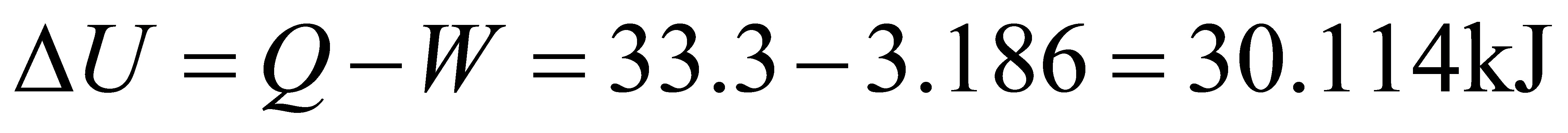 2分
2分
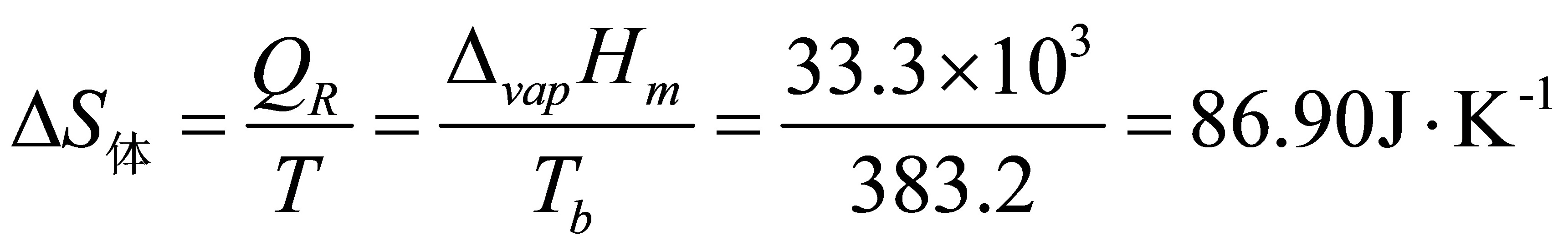 2分
2分
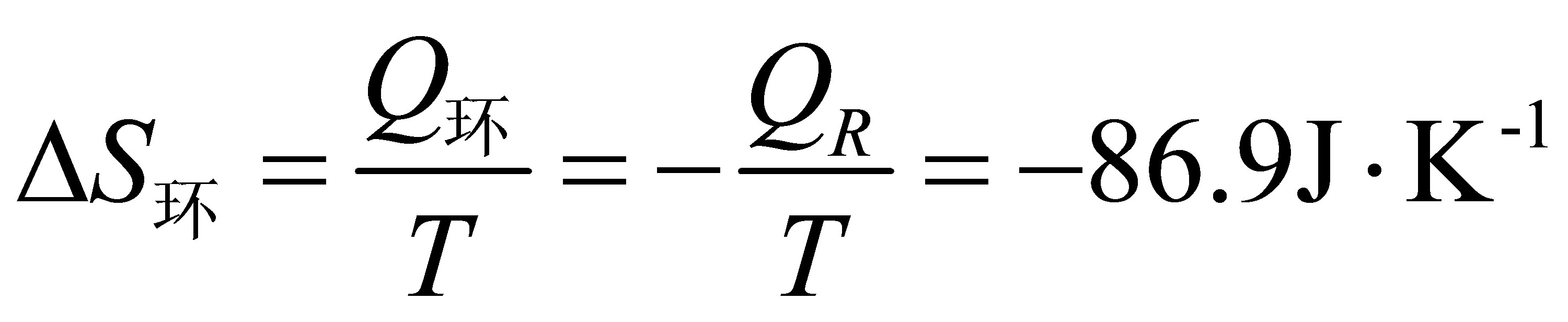 2分
2分
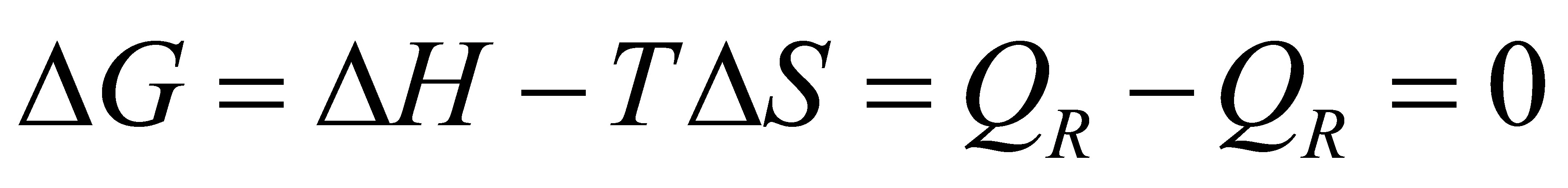 2分
2分
.1mol 理想气体从300K ;100kPa下等压加热到600K;求此过程的Q、W、U、H、S、G。已知此理想气体300K时的S=150.0J·K·mol;c=30.00 J·K·mol。(10分)